
Wetenschap
Waarom is de vloeistofvorm van een materiaal over het algemeen koeler dan het gas datzelfde materiaal?
Over het algemeen:
* vloeistoffen hebben sterkere intermoleculaire krachten: Moleculen in vloeistoffen zijn dichter bij elkaar dan in gassen en ervaren sterkere attracties. Deze attracties vereisen energie om te overwinnen, wat betekent dat vloeistoffen in het algemeen lagere kinetische energie (en dus lagere temperatuur) hebben dan gassen.
* vloeistoffen zijn dichter: De dichtheid van een vloeistof is veel hoger dan de dichtheid van een gas. Dit betekent dat vloeistoffen meer moleculen hebben verpakt in een bepaald volume, wat kan leiden tot meer botsingen en een lagere gemiddelde kinetische energie.
Uitzonderingen:
* kookpunt: Wanneer een vloeistof zijn kookpunt bereikt, begint deze in een gas te veranderen. Op dit punt kan de gasfase * * op dezelfde temperatuur zijn als de vloeibare fase.
* oververhitte vloeistoffen: Onder bepaalde omstandigheden kunnen vloeistoffen boven hun kookpunt worden verwarmd zonder te koken. Dit wordt een "oververhitte vloeistof" genoemd en kan * heter * zijn dan de gasfase van hetzelfde materiaal.
* specifieke materialen: Sommige materialen, zoals water, hebben een unieke eigenschap waar hun vaste vorm (ijs) * minder dicht * is dan de vloeibare vorm. Dit is de reden waarom ijs zweeft! In deze gevallen kan de vaste vorm * kouder * zijn dan de vloeibare vorm.
Samenvattend:
Hoewel het waar is dat vloeistoffen over het algemeen lagere temperaturen hebben dan gassen van hetzelfde materiaal, is dit niet altijd het geval. De specifieke voorwaarden en eigenschappen van het materiaal spelen een cruciale rol.
 Hoe dynamische druk te berekenen
Hoe dynamische druk te berekenen  Welk gas komt vrij uit Alka Seltzer?
Welk gas komt vrij uit Alka Seltzer?  Surface defect engineering van nanodraadarrays naar efficiënte stikstofreductie voor ammoniaksynthese
Surface defect engineering van nanodraadarrays naar efficiënte stikstofreductie voor ammoniaksynthese Verantwoording voor sekseverschillen in biomedisch onderzoek
Verantwoording voor sekseverschillen in biomedisch onderzoek Wat is een overvloedig aanwezig element in zowel watermoleculen als de meeste organische moleculen?
Wat is een overvloedig aanwezig element in zowel watermoleculen als de meeste organische moleculen?
 Opeenvolging van vegetatie beïnvloedt de bodemkwaliteit in het subtropische karstlandschap van China
Opeenvolging van vegetatie beïnvloedt de bodemkwaliteit in het subtropische karstlandschap van China Het negeren van klimaatverandering zal leiden tot ongekende, maatschappelijk ontwrichtende hitte-extremen in het Midden-Oosten
Het negeren van klimaatverandering zal leiden tot ongekende, maatschappelijk ontwrichtende hitte-extremen in het Midden-Oosten Agrivoltaics blijkt wederzijds voordelig voor voedsel, water, energie nexus
Agrivoltaics blijkt wederzijds voordelig voor voedsel, water, energie nexus Risico op tsunami's in Middellandse Zee is overschat
Risico op tsunami's in Middellandse Zee is overschat Analyse van de stadsboerderijen en tuinen van Baltimore City vindt veilige niveaus van metalen op de overgrote meerderheid van de locaties
Analyse van de stadsboerderijen en tuinen van Baltimore City vindt veilige niveaus van metalen op de overgrote meerderheid van de locaties
Hoofdlijnen
- Welke soorten organismen leefden voordat de mens op aarde verscheen?
- Hoe de interactie tussen mens en poema het voedselweb kan veranderen
- Wat zou het aminozuur zijn als er een mutatie was en UAG veranderde in UCG?
- Wat moet de wetenschapper doen als zijn hypothese niet correct is?
- Werkt de gramkleuringsprocedure voor alle bacteriën?
- Dit is wat de wetenschap zegt over dierengevoel
- Hoe nieuwe plantensoorten hun naam krijgen
- Wetenschappers leggen uit hoe diverse soorten naast elkaar bestaan in microbiële gemeenschappen
- Wat zijn de primaire seksorganen van het vrouwelijke reproductieve systeem?
- In het laboratorium gekweekt weefsel volgen met licht

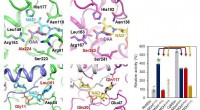
- Onderzoekers geven advies over stikstofactivering door reductie en oxidatie
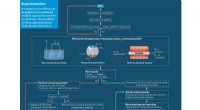
- Verbetering van de efficiëntie, helderheid van perovskiet-LED's

- Onderzoekers presenteren een microbiële stam die in staat is tot massale barnsteenzuurproductie
- Video:Zal het cryogeen bevriezen en weer tot leven komen ooit werkelijkheid worden?

 Het complexe verband tussen bevolkingsafname en een opwarmende planeet
Het complexe verband tussen bevolkingsafname en een opwarmende planeet Bijna 100 aardbevingen overspoelen Yellowstone in 24 uur. Dit is wat experts zeggen
Bijna 100 aardbevingen overspoelen Yellowstone in 24 uur. Dit is wat experts zeggen  Afbeelding:Hubble legt supernova-gaststelsel vast
Afbeelding:Hubble legt supernova-gaststelsel vast Emissievrij Boston kan jaarlijks 288 levens en $ 2,4 miljard redden
Emissievrij Boston kan jaarlijks 288 levens en $ 2,4 miljard redden Bots richten zich daadwerkelijk op individuele influencers
Bots richten zich daadwerkelijk op individuele influencers EU bereidt belasting op Amerikaanse tech-titanen voor
EU bereidt belasting op Amerikaanse tech-titanen voor Welke lage landen zijn tussen bergen of heuvels?
Welke lage landen zijn tussen bergen of heuvels?  Is een atoom met zes elektronen stabieler dan één?
Is een atoom met zes elektronen stabieler dan één?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

