
Wetenschap
Is een atoom met zes elektronen stabieler dan één?
* stabiliteit is relatief: Atomen streven naar een stabiele elektronenconfiguratie, meestal door een volledige buitenste schaal van elektronen te hebben.
* Aantal elektronen is niet de enige factor: Het aantal protonen (dat het element bepaalt) en de opstelling van elektronen (in orbitalen) zijn cruciaal voor stabiliteit.
Voorbeelden:
* koolstof (6 protonen): Koolstof heeft 6 elektronen. Het is op zichzelf niet bijzonder stabiel, omdat het slechts 4 in zijn buitenste schaal heeft. Het heeft de neiging om bindingen te vormen met andere atomen om een volledige buitenste schaal te bereiken.
* stikstof (7 protonen): Stikstof heeft 7 elektronen. Het is stabieler dan koolstof omdat de buitenste schaal 5 elektronen heeft, wat betekent dat het slechts één weg is van een volledige schaal.
* neon (10 protonen): Neon heeft 10 elektronen met een volledige buitenste schaal. Het is erg stabiel en bestaat als een edelgas.
Conclusie:
Een atoom met zes elektronen kan * stabieler zijn * dan een atoom met één elektron, maar het is geen garantie. Stabiliteit is afhankelijk van het element en de elektronenconfiguratie.
 Hoe een microscoop op te slaan
Hoe een microscoop op te slaan  Hoe het percentage ionisatie te berekenen gegeven de pH
Hoe het percentage ionisatie te berekenen gegeven de pH  Hoe gemeenschappelijke elementen een meer energiezekere toekomst kunnen maken
Hoe gemeenschappelijke elementen een meer energiezekere toekomst kunnen maken Wat gebruik je in de wetenschap voor het overbrengen van vloeistoffen naar containers met smalle opening?
Wat gebruik je in de wetenschap voor het overbrengen van vloeistoffen naar containers met smalle opening?  Nieuwe spin-overgang metaal-organische raamwerken gebruiken veel minder energie om vast te leggen, hergebruik koolmonoxide
Nieuwe spin-overgang metaal-organische raamwerken gebruiken veel minder energie om vast te leggen, hergebruik koolmonoxide
 AI's impact op VN-doelen voor klimaat, ontwikkeling en mondiale stabiliteit voor het eerst geanalyseerd
AI's impact op VN-doelen voor klimaat, ontwikkeling en mondiale stabiliteit voor het eerst geanalyseerd Veranderende stedelijke bevolkingsdichtheid zal invloed hebben op het toekomstige energieverbruik van gebouwen, volgens onderzoekers
Veranderende stedelijke bevolkingsdichtheid zal invloed hebben op het toekomstige energieverbruik van gebouwen, volgens onderzoekers Onderzoekers suggereren dat vleeskuikens het kenmerk zijn van het Antropoceen
Onderzoekers suggereren dat vleeskuikens het kenmerk zijn van het Antropoceen Bestaande klimaatmodellen nuttig bij het voorspellen, model testen
Bestaande klimaatmodellen nuttig bij het voorspellen, model testen Schonere lucht, minder bodemverontreiniging:onbedoeld maar gunstig neveneffect van Clean Air Act
Schonere lucht, minder bodemverontreiniging:onbedoeld maar gunstig neveneffect van Clean Air Act
Hoofdlijnen
- Waarom is celspecialisatie belangrijk voor ongewervelde dieren?
- Uit welke componenten bestaat een ATP-molecuul?
- Wat produceert een peulvruchten?
- Waarom moet de cel erfelijk materiaal kopiëren voordat hij zich verdeelt?
- Chargaff -bijdrage aan de structuur van DNA?
- Nieuw model helpt verklaren hoe voorzieningen ziekten in het wild bevorderen of verminderen
- Wat vond Lamarck dat evolutie betrokken was waardoor zijn idee onjuist was?
- Routes uit isolatie voor Yellowstone grizzlyberen
- Een bepaalde diersoort heeft zes paren chromosomen Hoeveel DNA -moleculen zijn deze dieren tijdens de G2 -fase aanwezig in de kernen?
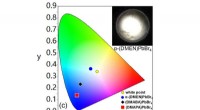
- Door de interne structuur van 2D-hybride perovskietmaterialen te wijzigen, zenden ze wit licht uit
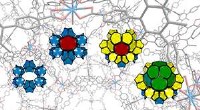
- Een poreus porfyrine gebruiken om edele metalen terug te winnen uit elektronisch afval

- Twee eenvoudige bouwstenen produceren complex 3D-materiaal
- Rh-ensemblekatalysator voor effectieve behandeling van uitlaatgassen van auto's

- Je gelooft het maar:caloriearme spread voornamelijk gemaakt van water

 Duitsland geeft keurmerk aan vrachtwagendraaiassistent
Duitsland geeft keurmerk aan vrachtwagendraaiassistent Noem de toestandsverandering die optreedt wanneer osmium wordt verwarmd van 4000© naar 6000©?
Noem de toestandsverandering die optreedt wanneer osmium wordt verwarmd van 4000© naar 6000©?  Geleerde onderzoekt biraciale jongeren politieke attitudes en zelfidentificatiefactoren
Geleerde onderzoekt biraciale jongeren politieke attitudes en zelfidentificatiefactoren Wat is Pascals Triangle?
Wat is Pascals Triangle?  Trek naar de bumper
Trek naar de bumper De Indonesische berg Sinabung schiet een rookkolom en as de lucht in
De Indonesische berg Sinabung schiet een rookkolom en as de lucht in Foxconn zegt dat er geen wijzigingen zijn gepland voor het Wisconsin-project
Foxconn zegt dat er geen wijzigingen zijn gepland voor het Wisconsin-project Gewichtloze actie op het ruimtestation - kracht, botten en bubbels
Gewichtloze actie op het ruimtestation - kracht, botten en bubbels
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

