
Wetenschap
Heeft zuurstof hetzelfde oxidatienummer in ozon O3 en zuurstof O2?
* zuurstof (O2): In het diatomaire zuurstofmolecuul delen de twee zuurstofatomen elektronen gelijk. Dit resulteert in een oxidatienummer van 0 Voor elk zuurstofatoom.
* ozone (o3): Ozone heeft een complexere structuur. Het centrale zuurstofatoom vormt enkele bindingen met de andere twee zuurstofatomen. Vanwege het verschil in elektronegativiteit tussen zuurstofatomen heeft het centrale zuurstofatoom een gedeeltelijke negatieve lading, terwijl de andere twee zuurstofatomen een gedeeltelijke positieve lading hebben. Dit leidt tot een oxidatienummer van -1 Voor het centrale zuurstofatoom en +1 voor de andere twee zuurstofatomen.
Daarom is het oxidatienummer van zuurstof in ozon (O3) niet hetzelfde als in zuurstof (O2).
 Koolstofuitstoot en El Nino zorgen ervoor dat de oceanen recordtemperaturen bereiken
Koolstofuitstoot en El Nino zorgen ervoor dat de oceanen recordtemperaturen bereiken  Hoe graancirkels werken
Hoe graancirkels werken  Veranderen gedachten aan de dood onze winkelgewoonten?
Veranderen gedachten aan de dood onze winkelgewoonten?  Kleine ijsverliezen aan de randen van Antarctica kunnen het ijsverlies ver weg versnellen
Kleine ijsverliezen aan de randen van Antarctica kunnen het ijsverlies ver weg versnellen NASA-NOAA-satelliet vangt orkaan Barbara's oog dicht
NASA-NOAA-satelliet vangt orkaan Barbara's oog dicht
Hoofdlijnen
- Waarom zijn Endospores een belangrijke overweging voor de conservenindustrie?
- Wat is het levensmodel?
- Biologen ontsluiten 'black box' naar de ondergrondse wereld:onderzoek toont aan hoe kleine microben het leven van mensen gemakkelijker maken
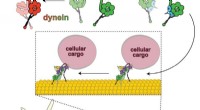
- Een nieuwe studie geeft een belangrijk inzicht in de manier waarop moleculaire motoreiwitten betrokken zijn bij de overdracht van malaria
- Onderzoek kwantificeert hoe miljoenen cellen in zebravisembryo's worden beïnvloed door belangrijke genveranderingen
- Wat is mutatie.?
- Heeft een dierencel SAP?
- Zijn eicellen bij ouder wordende primaten beschermd tegen mutaties?
- Hypermutators zorgen ervoor dat pathogene schimmels sneller evolueren
- Nieuwe chemische synthesemethode kan een opwindende reeks nieuwe verbindingen produceren
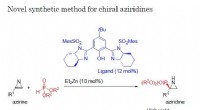
- Wetenschappers produceren eerste open source all-atom-modellen van COVID-19 spike-eiwit

- Nieuw type elektrolyt kan de prestaties van supercondensatoren verbeteren

- Hoge reactiesnelheden, zelfs zonder edele metalen

- Biochemici onthullen moleculair mechanisme voor regulatie van motoreiwitten
 Is het oplossen van jodium in alcohol een chemische of fysische verandering?
Is het oplossen van jodium in alcohol een chemische of fysische verandering?  Kun je een T500 ma -keramische zekering vervangen door een F500 -zekering?
Kun je een T500 ma -keramische zekering vervangen door een F500 -zekering?  'S Werelds verouderende grote dammen vormen een opkomend risico:UN
'S Werelds verouderende grote dammen vormen een opkomend risico:UN Onderzoekers onthullen hoe moleculaire wegversperringen de afbraak van cellulose voor biobrandstoffen vertragen
Onderzoekers onthullen hoe moleculaire wegversperringen de afbraak van cellulose voor biobrandstoffen vertragen  Wat is zuurder zwavelzuur of salpeterzuur?
Wat is zuurder zwavelzuur of salpeterzuur?  Vulkanen en hun soorten uitbarstingen
Vulkanen en hun soorten uitbarstingen Wat als je een pistool in de ruimte neerschiet?
Wat als je een pistool in de ruimte neerschiet?  Zwaartekrachtgolven beïnvloeden weer en klimaat
Zwaartekrachtgolven beïnvloeden weer en klimaat
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

