
Wetenschap
Welke eigenschap van metalen bindingen beïnvloeden de thermische en elektrische geleidbaarheidsmetalen?
Dit is waarom:
* Gedelokaliseerde elektronen: In een metalen binding zijn de valentie -elektronen niet gebonden aan een specifiek atoom en zijn ze vrij om door het gehele kristalrooster te bewegen. Deze "zee" van gedelokaliseerde elektronen geeft metalen hun unieke eigenschappen.
* Thermische geleidbaarheid: Wanneer warmte op een metaal wordt aangebracht, absorberen de vrije elektronen de energie en beginnen ze sneller te bewegen. Deze bekrachtigde elektronen botsen met aangrenzende elektronen en brengen de warmte -energie over het materiaal over. Hoe vrijer elektronen kunnen bewegen, hoe efficiënter warmte kan worden uitgevoerd.
* elektrische geleidbaarheid: Evenzo, wanneer een elektrisch potentieel op een metaal wordt toegepast, stromen de gedelokaliseerde elektronen vrij door het materiaal, waardoor een elektrische stroom ontstaat. Hoe hoger de dichtheid van vrije elektronen en hoe gemakkelijker ze kunnen bewegen, hoe beter de elektrische geleidbaarheid.
Samenvattend is het vermogen van elektronen om vrij te bewegen binnen de metalen structuur de fundamentele reden voor de uitstekende thermische en elektrische geleidbaarheid van metalen.
 Een monster van een verbinding bevat 64 gram koper en 16 gram zuurstof. Wat is de verhouding tussen massa en zuurstof?
Een monster van een verbinding bevat 64 gram koper en 16 gram zuurstof. Wat is de verhouding tussen massa en zuurstof?  Ontdek de chemie achter de liefde op Valentijnsdag
Ontdek de chemie achter de liefde op Valentijnsdag  Wetenschappers gebruiken trechtervisie om goedkope en efficiënte zonne-energie te pionieren
Wetenschappers gebruiken trechtervisie om goedkope en efficiënte zonne-energie te pionieren Onderzoekers demonstreren de hoogste gerapporteerde geleidbaarheid voor organisch radicaalpolymeer
Onderzoekers demonstreren de hoogste gerapporteerde geleidbaarheid voor organisch radicaalpolymeer Hoe zou je 0,025 M fosforzuur bereiden?
Hoe zou je 0,025 M fosforzuur bereiden?
 Onderzoek wijst uit hoe vissen in de schemerzone evolueerden
Onderzoek wijst uit hoe vissen in de schemerzone evolueerden  Waarom invasieve mieren een stille bedreiging vormen voor onze ecosystemen
Waarom invasieve mieren een stille bedreiging vormen voor onze ecosystemen  In het verschroeide VK droogt de bron van de rivier de Theems op
In het verschroeide VK droogt de bron van de rivier de Theems op Wereldwijde CO2-uitstoot daalt met 4-7% in 2020, maar zal het uitmaken?
Wereldwijde CO2-uitstoot daalt met 4-7% in 2020, maar zal het uitmaken? Landbouwhulpmiddelen in het oude Egypte
Landbouwhulpmiddelen in het oude Egypte
Hoofdlijnen
- FReD kan helpen verklaren hoe een bij ziet
- Wat is een anaërobe functie?
- Valse oogvlekken intimideren roofdieren, onderzoekers vinden
- Welke mRNA-streng zou worden gemaakt tijdens transcriptie met behulp van het DNA dat hieronder wordt weergegeven AGC GCT?
- Wat is een pseudogeen?
- Hoe wordt een meniscus gebruikt bij het meten?
- Aan welke regio van de operon bindt de repressor?
- Inktvissen horen boeggolf van dreigend gevaar
- Hoe microben de gezondheid van koraalriffen weerspiegelen
- Verrassende ontdekking kan de manier waarop de industrie nikkel gebruikt veranderen

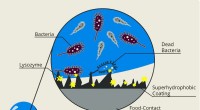
- Nieuwe coating met dubbele werking voorkomt dat bacteriën kruisbesmetting van verse producten mogelijk maken
- Betaalbare loodsensor voor thuis, stadswaterleidingen

- Zika-viruseiwit in kaart gebracht om het zoeken naar genezing te versnellen
- Ijzer- en zinktekorten aanpakken met beter brood

 Zeer gevoelige trigger maakt snelle detectie van biologische agentia mogelijk
Zeer gevoelige trigger maakt snelle detectie van biologische agentia mogelijk Levenscyclus van een pauw
Levenscyclus van een pauw  Onderzoekers bestuderen effecten van cellulaire crowding op het celtransportsysteem
Onderzoekers bestuderen effecten van cellulaire crowding op het celtransportsysteem Samenwerking maakt kristalheldere studie van stralingsreactie mogelijk
Samenwerking maakt kristalheldere studie van stralingsreactie mogelijk Indonesiërs verstikt door bosbrandnevel bidden om regen
Indonesiërs verstikt door bosbrandnevel bidden om regen Veel Afrikaanse landen overstromen, decennia van ontwikkeling riskeren als ze zich niet aanpassen
Veel Afrikaanse landen overstromen, decennia van ontwikkeling riskeren als ze zich niet aanpassen CRISPR-bewerking van mitochondriën:veelbelovende nieuwe biotechnologie?
CRISPR-bewerking van mitochondriën:veelbelovende nieuwe biotechnologie?  Zonnemodel dat wordt gebruikt om het vermogen van exoplaneten te voorspellen om stellaire wind te weerstaan
Zonnemodel dat wordt gebruikt om het vermogen van exoplaneten te voorspellen om stellaire wind te weerstaan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

