
Wetenschap
Hoe zou je 0,025 M fosforzuur bereiden?
De molaire massa van fosforzuur (H3PO4) is 97,994 g/mol. Om 1 liter fosforzuuroplossing van 0,025 M te bereiden, heeft u het volgende nodig:
0,025 M =(0,025 mol/l)/(97,994 g/mol) =2,44e-3 mol
Stap 2:Weeg het fosforzuur af
Weeg met een pipet 0,239 g fosforzuur af.
Stap 3:Los het fosforzuur op in een kleine hoeveelheid water
Voeg het fosforzuur toe aan 100 ml gedeïoniseerd water in een bekerglas. Roer totdat het zuur volledig is opgelost.
Stap 4:Breng de oplossing over in een maatkolf en voeg meer water toe
Giet de fosforzuuroplossing in een maatkolf van 1 liter. Voeg meer gedeïoniseerd water toe totdat het totale volume van de oplossing 1 liter bereikt. Meng grondig.
Stap 5:Controleer de concentratie van de oplossing
Om de concentratie van de oplossing te verifiëren, kunt u een pH-meter of een geleidbaarheidsmeter gebruiken. De pH van de bereide 0,025 M fosforzuuroplossing moet ongeveer 1,52 zijn, wat overeenkomt met de verwachte concentratie.
 Loodhalogenideperovskieten zijn niet ferro-elektrisch
Loodhalogenideperovskieten zijn niet ferro-elektrisch Onderzoekers ontwikkelen kleinere, lichtere stralingsafscherming
Onderzoekers ontwikkelen kleinere, lichtere stralingsafscherming De voordelen van Chrome-vanadiumbladen
De voordelen van Chrome-vanadiumbladen Minder is meer als het gaat om het voorspellen van de geleidbaarheid van moleculen
Minder is meer als het gaat om het voorspellen van de geleidbaarheid van moleculen Wetenschappers bouwen chip om gezondheid van witte bloedcellen te analyseren
Wetenschappers bouwen chip om gezondheid van witte bloedcellen te analyseren
Hoofdlijnen
- Een wetenschapper gebruikt kunstmatige selectie om een nieuw type koe te produceren. Vergeleken met hun ouders zijn de koeien?
- Bioreactorprocessen en cryotechnologieën verbeteren het testen van actieve ingrediënten met behulp van menselijke celculturen
- Natte celbatterij versus Dry Cell Battery
- Wat zijn de verschillen tussen een virus en een parasiet?
- Wetenschappers beoordelen de mogelijkheden om kariboes in BC te behouden totdat het leefgebied zich herstelt
- Moet mRNA in een lipidelaag worden gehuld om als vaccin te dienen?
- Hoe bedreigingsdetectiemechanismen van planten alarm slaan
- Noorwegen zet hek op om rendierslachting te stoppen
- Wat is de definitie van toegevoegde suiker?
- Wat als vliegtuigen hun eigen schade konden herstellen?

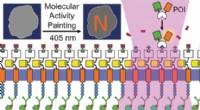
- Molecular activity painting om schakelaarachtige, lichtgestuurde verstoringen in cellen
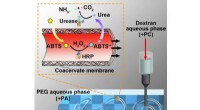
- Materiaalwetenschappers bouwen een synthetisch systeem met compartimenten zoals echte cellen
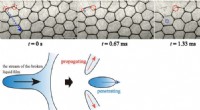
- Twee verschillende fysieke mechanismen geïdentificeerd voor hoe eenvoudig schuim instort
- Wetenschappers ontwerpen organische kathode voor hoogwaardige batterijen

 Californië stelt strenge limiet voor giftige chemicaliën in drinkwater voor
Californië stelt strenge limiet voor giftige chemicaliën in drinkwater voor Ook na hervormingen weinig ineffectieve leraren worden geïdentificeerd als ineffectief, studie vondsten
Ook na hervormingen weinig ineffectieve leraren worden geïdentificeerd als ineffectief, studie vondsten Hebben Amerikanen een identiteitscrisis als het gaat om ras en etniciteit?
Hebben Amerikanen een identiteitscrisis als het gaat om ras en etniciteit?  'Leaveism' en 'presenteïsme' blijven bestaan, zelfs als werkgevers flexibeler zijn. Hier leest u hoe u gelukkiger kunt zijn op het werk
'Leaveism' en 'presenteïsme' blijven bestaan, zelfs als werkgevers flexibeler zijn. Hier leest u hoe u gelukkiger kunt zijn op het werk  De bewegende boogschok van Mars
De bewegende boogschok van Mars Wat is een oplossing in de wetenschap?
Wat is een oplossing in de wetenschap?  Grotkunst uit de Filipijnen wordt voor het eerst direct gedateerd in Zuidoost-Azië
Grotkunst uit de Filipijnen wordt voor het eerst direct gedateerd in Zuidoost-Azië WPI-ingenieurs die geminiaturiseerde, draadloze zuurstofsensor voor zieke baby's
WPI-ingenieurs die geminiaturiseerde, draadloze zuurstofsensor voor zieke baby's
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

