
Wetenschap
Met wat voor soort binding kan metalen worden afgevlakt en gevormd?
Dit is waarom:
* Zee van elektronen: Bij metalen binding zijn de valentie -elektronen van de metaalatomen gedelocaliseerd, wat betekent dat ze niet gebonden zijn aan een bepaald atoom en vrij kunnen bewegen door de gehele metaalstructuur. Dit creëert een "zee" van elektronen die de positief geladen metaalionen omringen.
* Niet-directionele binding: In tegenstelling tot covalente of ionische bindingen is metaalbinding niet-directioneel. De elektrostatische aantrekkingskracht tussen de positieve ionen en de elektronenzee is niet in een specifieke richting gericht.
* Ductiliteit en kneedbaarheid: Deze niet-directionele aard van metaalbinding is de sleutel tot ductiliteit en kneedbaarheid van metalen. Wanneer kracht wordt uitgeoefend, kunnen de positieve metaalionen langs elkaar glijden zonder de bindingen te verbreken. Hierdoor kunnen metalen worden vervormd zonder te breken, waardoor ze kunnen worden afgevlakt, uitgerekt of gevormd in verschillende vormen.
Samenvattend: De zee van elektronen in metalen binding zorgt ervoor dat de metaalionen vrij bewegen, waardoor de bindingen flexibel worden en metalen kunnen worden gevormd zonder te breken.
 Nieuwe tool maakt beeldvorming van neurale activiteit mogelijk met nabij-infrarood licht
Nieuwe tool maakt beeldvorming van neurale activiteit mogelijk met nabij-infrarood licht Een vreemd fenomeen ontrafelen dat zowel de prestaties van lithium-ionbatterijen helpt als schaadt
Een vreemd fenomeen ontrafelen dat zowel de prestaties van lithium-ionbatterijen helpt als schaadt Nieuwe 3D-geprinte technologie verlaagt de kosten van algemene medische tests
Nieuwe 3D-geprinte technologie verlaagt de kosten van algemene medische tests Elektrofotokatalytische diaminatie van vicinale C-H-bindingen
Elektrofotokatalytische diaminatie van vicinale C-H-bindingen De onderstaande afbeelding toont een pot met daarin vier verschillende vloeistoffen, elke kleur vloeistoffen mengt niet, dus de kleuren blijven gescheiden. Welke van deze heeft een dichtheid die groter is dan die van?
De onderstaande afbeelding toont een pot met daarin vier verschillende vloeistoffen, elke kleur vloeistoffen mengt niet, dus de kleuren blijven gescheiden. Welke van deze heeft een dichtheid die groter is dan die van?
 Vijf manieren om steden koel te houden tijdens een hittegolf
Vijf manieren om steden koel te houden tijdens een hittegolf  Klimaatwetenschapper over VN-rapport:net zo erg als we hadden verwacht
Klimaatwetenschapper over VN-rapport:net zo erg als we hadden verwacht Rookverbod Singapore klinkt radicaal, maar het is een vreemde manier om luchtvervuiling te verminderen
Rookverbod Singapore klinkt radicaal, maar het is een vreemde manier om luchtvervuiling te verminderen Hoe heeft de wetenschap betrekking op de wetenschap?
Hoe heeft de wetenschap betrekking op de wetenschap?  Zwarte slangen met gele ringen in Georgia
Zwarte slangen met gele ringen in Georgia
Hoofdlijnen
- Welk concept bevat de gen-chromosoomtheorie?
- Dankzij een krachtige nieuwe techniek kunnen wetenschappers bestuderen hoe eiwitten in cellen van vorm veranderen
- Genen die mensen scheiden van fruitvliegen gevonden
- Waarvoor voeden Ascaris?
- Zeepaardjesvaders bevallen op een unieke manier, blijkt uit nieuw onderzoek
- Voedingsgewoonte van Maleisische fruitvleermuizen
- Een adjuvans gemaakt in gist zou de vaccinkosten kunnen verlagen en de beschikbaarheid kunnen vergroten
- Welke voedingsstof is een isolator voor uw lichaam?
- Japanse sake:de nieuwe opkikker? Giststam maakt vermoeidheidsbestrijdende aminozuren aan
- De opmerkelijke variabiliteit van elektronische structuren van actinidetetrafluoride

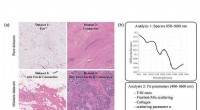
- Bevindingen bevestigen het vermogen van beeldvormende technieken om gezond weefsel te onderscheiden na neoadjuvante chemotherapie
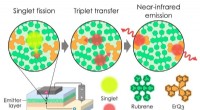
- Excitonlimieten zijn bedoeld om te worden overschreden:OLED overtreft 100 procent excitonproductie-efficiëntie
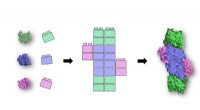
- Legos of life:een diepe duik in de 3D-structuren van eiwitten onthult belangrijke bouwstenen
- Gecko-adhesietechnologie komt dichter bij industrieel gebruik

 Heeft de breedte van een elastiekje invloed op hoe ver het zal uitrekken?
Heeft de breedte van een elastiekje invloed op hoe ver het zal uitrekken?  Hoe een lang verloren gewaande vissoort werd teruggebracht naar Bendigo
Hoe een lang verloren gewaande vissoort werd teruggebracht naar Bendigo  Sommige immigranten zien legale status als een weg naar deportatie
Sommige immigranten zien legale status als een weg naar deportatie Wat is een fasediagram?
Wat is een fasediagram?  Ultrakoude lithiumatomen werpen licht op paarvorming in supervloeistoffen, helpen bij het identificeren van de beste theorieën
Ultrakoude lithiumatomen werpen licht op paarvorming in supervloeistoffen, helpen bij het identificeren van de beste theorieën Wat is de naam van de plant zonder wortel?
Wat is de naam van de plant zonder wortel?  Is benzoëzuur oplosbaar in NaOH?
Is benzoëzuur oplosbaar in NaOH?  Warm ijs in 's werelds hoogste gletsjer
Warm ijs in 's werelds hoogste gletsjer
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

