
Wetenschap
Welke formele lading heeft koolstof?
Dit is waarom:
* valentie -elektronen: Koolstof heeft 4 valentie -elektronen.
* bindingen: Koolstof vormt meestal 4 covalente bindingen en deelt één elektron met elk atoom waaraan het bindt.
* Formele ladingsberekening: Formele lading wordt berekend als:
* Formele lading =(valentie -elektronen) - (niet -bindende elektronen) - (1/2 * bindingselektronen)
* In het geval van koolstof zou dit 4 - 0 - (1/2 * 8) zijn =0
Koolstof kan echter in bepaalde situaties een formele lading hebben, zoals:
* carbocaties: Deze hebben een positieve formele lading op koolstof vanwege het verlies van een elektron.
* carbanions: Deze hebben een negatieve formele lading op koolstof vanwege de versterking van een elektron.
Het is belangrijk op te merken dat de formele lading slechts een theoretische waarde is en dat de werkelijke ladingsverdeling in een molecuul complexer is.
Hoofdlijnen
- CRISPR-octrooioorlogen benadrukken het probleem van het verlenen van brede intellectuele eigendomsrechten voor technologie die publieke voordelen biedt
- Hoe komen de spermacellen in een stuifmeelkorrel aan bij de eicelklus in een plant-ovule?
- Bloedagar en chocolade zijn soorten verrijkte media die zeker remmen?
- Hoe de varkensgriep werkt
- Deze kleine ouders van koraalrifvissen beslissen wanneer hun embryo's uitkomen
- Wat is nephoning en waarom hebben de officiële tests dit niet opgepikt?
- Welke vakken studeren wetenschapper?
- Wetenschappers vinden een manier om de negatieve impact van wolluizen op wijngaarden te voorkomen
- Hoe zien de bewakingscellen en de huidmondjes eruit?
- Grootste record voor aromatische ringmaat verbroken met 162 π elektronen
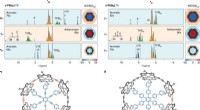
- Vergelijking van de chemie van waterisomeren
- Waarom ananasbladeren een veelbelovende kandidaat zijn ter vervanging van plastic materialen die worden gebruikt in maskers voor eenmalig gebruik

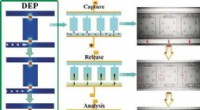
- Microfluïdische chip voor analyse van afzonderlijke cellen
- 3D-elektronenmicroscopie onthult de complexe ingewanden van ontziltingsmembranen

 Afbeelding:Petermann-gletsjer, Groenland
Afbeelding:Petermann-gletsjer, Groenland Onderzoekers creëren een nieuw akoestisch slim materiaal geïnspireerd op haaienhuid
Onderzoekers creëren een nieuw akoestisch slim materiaal geïnspireerd op haaienhuid Moleculaire gevangenis dwingt diatomische gevangenen naar celvloer
Moleculaire gevangenis dwingt diatomische gevangenen naar celvloer Compostprogramma's van de stad veranderen afval in zwart goud dat de voedselzekerheid en sociale rechtvaardigheid verhoogt
Compostprogramma's van de stad veranderen afval in zwart goud dat de voedselzekerheid en sociale rechtvaardigheid verhoogt Wat betekent botssnelheid?
Wat betekent botssnelheid?  China's meest smoggste stad sluit scholen te midden van publieke woede
China's meest smoggste stad sluit scholen te midden van publieke woede Hoe te weten of een stof een reductiemiddel of een oxidatiemiddel is door het periodiek systeem?
Hoe te weten of een stof een reductiemiddel of een oxidatiemiddel is door het periodiek systeem?  Stabiliteit van de grootste ijsklomp op aarde die gevaar loopt door opwarmende oceanen
Stabiliteit van de grootste ijsklomp op aarde die gevaar loopt door opwarmende oceanen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


