Wetenschap
Microfluïdische chip voor analyse van afzonderlijke cellen
Krediet:Wiley
Een paar kleine cellen die anders zijn dan de rest, kunnen een groot effect hebben. Bijvoorbeeld, individuele kankercellen kunnen resistent zijn tegen een specifieke chemotherapie, waardoor een terugval ontstaat bij een patiënt die anders genezen zou zijn. In het journaal Angewandte Chemie , wetenschappers hebben nu een op microfluïdica gebaseerde chip geïntroduceerd voor de manipulatie en daaropvolgende nucleïnezuuranalyse van individuele cellen. De techniek maakt gebruik van lokale elektrische velden om de cellen zeer efficiënt te "vangen" (diëlektroforese).
Moleculaire analyses van individuele cellen zijn nodig om de rol van heterogene celpopulaties bij de ontwikkeling van ziekten beter te begrijpen en om effectieve therapieën voor gepersonaliseerde geneeskunde te ontwikkelen. Het identificeren van individuele cellen in een massa andere cellen is een enorme uitdaging in de diagnostische geneeskunde. De cellen moeten worden gesorteerd, gehouden, overgebracht naar een andere container met een extreem klein volume ( <1 L) en moet vervolgens moleculaire analyse ondergaan. Conventionele methoden zijn meestal erg tijdrovend en complex, maar ook onbetrouwbaar en inefficiënt. Ze kunnen ook de levensvatbaarheid van de cellen in gevaar brengen, grote monstervolumes nodig hebben, een hoog risico op besmetting hebben, en/of dure instrumenten nodig hebben.
Wetenschappers van de Universiteit van Washington (Seattle, VS), Iowa State University (Ames, VS), en Fred Hutchinson Cancer Research Center (Seattle, VS) hebben microfluïdische technologie gebruikt om deze problemen op te lossen. Alle noodzakelijke stappen worden betrouwbaar uitgevoerd op een speciaal ontwikkelde microchip met minimale hoeveelheden oplosmiddel en zonder dat de cellen moeten worden gemarkeerd. In tegenstelling tot conventionele microfluïdische chips, deze vereist geen complexe fabricagetechnologie of componenten zoals kleppen of roerwerken.
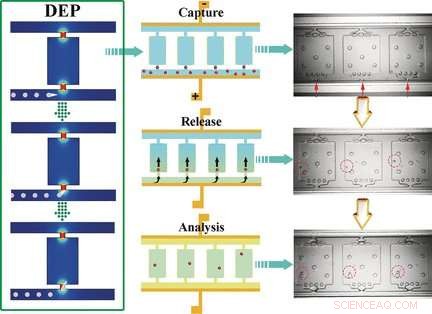
De Self-Digitization Dielectrophoretic (SD-DEP) chip is ongeveer zo groot als een munt en heeft twee parallelle microkanalen (50 m diep x 35 m breed x 3,2 cm lang) verbonden door talloze kleine kamertjes. De openingen van de microkanalen zijn slechts 15 m breed. Over de lengte van de kanalen wordt een dunne elektrode gespannen. De kanalen en kamers zijn gevuld met een buffer, een wisselspanning wordt toegepast, en het monster wordt toegevoegd aan een van de microkanalen. Het team onder leiding van Robbyn K. Anand en Daniel T. Chiu gebruikte leukemiecellen in hun experimenten.
Lokale maxima van het elektrische veld treden op bij de smalle ingangen van de kamers. Cellen die de kamers binnenkomen, worden "opgesloten". Omdat de afmetingen van de ingang vergelijkbaar zijn met de gemiddelde grootte van een cel, slechts een enkele cel kan worden opgesloten door elke kameringang. Wanneer de wisselstroom wordt uitgeschakeld en het debiet wordt verhoogd door injectie van de reagentia die nodig zijn voor de daaropvolgende analyse, de cellen worden in de kamers gewassen. Vervolgens wordt een olie toegevoegd om de kamers af te dichten. De cellen worden dan opgelost, en de nucleïnezuren worden afgegeven en vermenigvuldigd en kunnen worden geïdentificeerd als leukemiecellen door een markergen.
In toekomstige studies, de onderzoekers hopen de chip te gebruiken om de verspreiding te bepalen van genetische mutaties die verband houden met resistentie in leukemiecellen en dus recidieven kunnen veroorzaken.
 Hoe te bepalen of iets is verminderd of geoxideerd
Hoe te bepalen of iets is verminderd of geoxideerd Chemische agentia met vertrouwen detecteren
Chemische agentia met vertrouwen detecteren Kunstmatige en biologische cellen werken samen als mini-chemische fabrieken
Kunstmatige en biologische cellen werken samen als mini-chemische fabrieken Welke klassen moet je volgen op de middelbare school als je een chemisch ingenieur wilt worden?
Welke klassen moet je volgen op de middelbare school als je een chemisch ingenieur wilt worden?  Water verandert hoe een op kobalt gebaseerd molecuul koolstofdioxide omzet in een veelbelovende chemische stof
Water verandert hoe een op kobalt gebaseerd molecuul koolstofdioxide omzet in een veelbelovende chemische stof
 Plastic, papier of katoen:welke boodschappentas is het beste?
Plastic, papier of katoen:welke boodschappentas is het beste? Nieuw voorgestelde referentiedatasets verbeteren de kwaliteit van de gegevens van de weersatelliet
Nieuw voorgestelde referentiedatasets verbeteren de kwaliteit van de gegevens van de weersatelliet Biologen bedenken nieuwe manier om koolstof in de oceaan te beoordelen
Biologen bedenken nieuwe manier om koolstof in de oceaan te beoordelen Op weg naar duurzame energie in New York City
Op weg naar duurzame energie in New York City Waarom cloud seeding steeds aantrekkelijker wordt voor het dorstige Westen
Waarom cloud seeding steeds aantrekkelijker wordt voor het dorstige Westen
Hoofdlijnen
- Welke vier dingen maken ribosomen anders dan organellen?
- Is het tijd dat ons begrip van evolutie evolueert?
- Hoe is de taal geëvolueerd?
- Leven gelukkige mensen langer?
- Economen ontwikkelen besluitvormingsmethode voor beheer van koraalduivels
- Een biologische oplossing voor het afvangen en recyclen van koolstof?
- Hoe MRNA naar TRNA
- Goed excuus,
- Chimpansees in het wild wijzigen waarschuwingen op basis van wat anderen in hun groep al weten, studie vondsten
 Zonnecellen maken is als brood smeren
Zonnecellen maken is als brood smeren Hogescholen plannen voor virustesten, maar de strategieën lopen sterk uiteen
Hogescholen plannen voor virustesten, maar de strategieën lopen sterk uiteen Wetenschappers zetten koers om de geheimen van het verloren continent Zeelandia te ontrafelen
Wetenschappers zetten koers om de geheimen van het verloren continent Zeelandia te ontrafelen Haaien spotten drones op patrouille op Australische stranden
Haaien spotten drones op patrouille op Australische stranden Thaise retailers verbieden plastic tassen voor eenmalig gebruik
Thaise retailers verbieden plastic tassen voor eenmalig gebruik waarom natuur, geschiedenis en Amerikaanse cultuur maken sociaal isolement moeilijk
waarom natuur, geschiedenis en Amerikaanse cultuur maken sociaal isolement moeilijk Expert in vloeistofdynamica legt uit hoe je het risico op overdracht van COVID-19 in de lucht in een auto kunt verminderen
Expert in vloeistofdynamica legt uit hoe je het risico op overdracht van COVID-19 in de lucht in een auto kunt verminderen De commerciële gevolgen van collectieve ontslagen
De commerciële gevolgen van collectieve ontslagen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com