
Wetenschap
Waarom was de basis van het classificatie -element in de periodieke tabel gewijzigd van atomaire massa naar aantal?
1. Isotopen:
* Discovery: In het begin van de 20e eeuw ontdekten wetenschappers isotopen - atomen van hetzelfde element met verschillende atoommassa's vanwege verschillende aantallen neutronen. Dit daagde het idee uit dat atomaire massa het bepalende kenmerk van een element was.
* implicatie: Het werd duidelijk dat atomaire massa geen betrouwbare basis was voor het organiseren van elementen omdat elementen met vergelijkbare chemische eigenschappen verschillende atoommassa's konden hebben als gevolg van isotopen.
2. Moseley's experimenten:
* Bijdrage: Henry Moseley, in 1913, voerde experimenten uit met behulp van röntgenspectroscopie. Hij ontdekte dat de frequentie van röntgenfoto's die door een element werden uitgezonden, direct gerelateerd was aan het aantal protonen in zijn kern (atoomnummer).
* Betekenis: Dit bood een meer fundamentele en consistente basis voor het classificeren van elementen, omdat het atoomnummer constant bleef voor alle isotopen van een bepaald element.
3. Periodiek recht en atoomnummer:
* verbinding: De periodieke wet, waarin stelt dat de eigenschappen van elementen periodieke functies van hun atoomaantallen zijn, werd gestold door het werk van Moseley. Deze wet verklaarde de terugkerende patronen van chemische en fysische eigenschappen waargenomen in het periodiek systeem.
* Nieuwe bestelling: Het regelen van elementen door het vergroten van het atoomnummer in plaats van atomaire massa resulteerde in een meer accurate en consistente opstelling die de onderliggende orde van de elementen weerspiegelde.
Samenvattend:
* De ontdekking van isotopen toonde aan dat atomaire massa geen betrouwbare indicator was voor de identiteit van een element.
* Het werk van Moseley heeft een atoomnummer vastgesteld als een meer fundamentele eigendom dat de positie van een element in het periodiek systeem heeft bepaald.
* Het regelen van elementen op atoomnummer weerspiegelde beter de periodieke wet en de terugkerende eigenschappen van elementen.
De verschuiving van atomaire massa naar atoomnummer was een belangrijke vooruitgang in ons begrip van de elementen en hun organisatie, wat leidde tot een meer accurate en voorspellende periodiek systeem.
 Samen en beschrijf enkele bijgelovige overtuigingen van praktijken in de wetenschap?
Samen en beschrijf enkele bijgelovige overtuigingen van praktijken in de wetenschap?  New Jersey keurt gasleiding door beschermd Pinelands goed
New Jersey keurt gasleiding door beschermd Pinelands goed Bodemsoorten in koude woestijnen
Bodemsoorten in koude woestijnen  Beleid in kaart brengen hoe de EU haar impact op tropische ontbossing kan verminderen
Beleid in kaart brengen hoe de EU haar impact op tropische ontbossing kan verminderen Aardbevingen van september 2017 markeren successen van Mexico's systeem voor vroegtijdige waarschuwing
Aardbevingen van september 2017 markeren successen van Mexico's systeem voor vroegtijdige waarschuwing
Hoofdlijnen
- Welke weefsels zorgen ervoor dat organen niet uit elkaar vallen?
- Nieuw inzicht in waarom de ziekte van Pierce zo dodelijk is voor wijnstokken
- Studie onderzoekt welke micro-organismen op Mars nodig zouden hebben om te overleven
- Wat wordt het genoemd als bacteriën zich in twee cellen verdelen?
- Verenigen metabole reacties geïsoleerd op?
- Wat is de lichaamstemperatuur van het menselijk lichaam?
- Hoe zorgen planten voor hun zaden?
- Ontdekken van de verblijfplaats van de inclusieve zuidelijke rechtse walvis tijdens de warmere maanden
- Welk soort cel wordt ook een epitheelcel genoemd?
- Sleutelenzym dat in planten wordt aangetroffen, kan de ontwikkeling van medicijnen en andere producten leiden
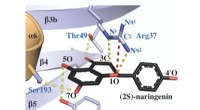
- Draagbare sensoren kunnen biotechnologie gebruiken om persoonlijke, milieugegevens
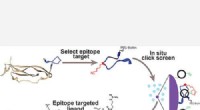
- Onderzoekers ontwikkelen potentieel goedkope, emissiearme technologie die methaan kan omzetten zonder CO2 . te vormen

- Vloeibaar forensisch onderzoek kan leiden tot veiliger drinkwater

- Van één uur tot één minuut:nieuwe analysetechniek vereenvoudigt het proces om bisfenol A-verontreinigingen te detecteren

 Archeologen vinden verloren klooster geregeerd door koningin van Mercia
Archeologen vinden verloren klooster geregeerd door koningin van Mercia De aarde verduistert door klimaatverandering
De aarde verduistert door klimaatverandering Versleutelde smartphones beveiligen uw identiteit, niet alleen uw gegevens
Versleutelde smartphones beveiligen uw identiteit, niet alleen uw gegevens James Webb Space Telescope legt het einde van de planeetvorming vast
James Webb Space Telescope legt het einde van de planeetvorming vast  De aarde draait de laatste tijd sneller
De aarde draait de laatste tijd sneller Hoe de waterradfabriek knapt
Hoe de waterradfabriek knapt  Onderzoekers snijden patronen ter grootte van nanometers in 2D-materialen
Onderzoekers snijden patronen ter grootte van nanometers in 2D-materialen Studie analyseert hoe factcheckers uit vier verschillende landen beweringen over klimaatverandering beoordelen
Studie analyseert hoe factcheckers uit vier verschillende landen beweringen over klimaatverandering beoordelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

