
Wetenschap
Hoe verschilt het atoommodel dat u vandaag hebt gebruikt, van Bohr -model?
Bohr -model (1913):
* Sleutelidee: Elektronen draaien de kern in specifieke, gekwantiseerde energieniveaus.
* sterke punten: Legde de lijnspectra van waterstofatomen en de stabiliteit van atomen uit.
* Beperkingen:
* Kon de spectra van atomen met meer dan één elektron niet verklaren.
* Gemaakte geen rekening met elektronenspin of de golfachtige aard van elektronen.
Modern Quantum Mechanical Model (1920s):
* Sleutelidee: Elektronen worden beschreven door golffuncties, die de kans geven een elektron te vinden in een specifiek gebiedsgebied.
* sterke punten:
* Legt de spectra van alle atomen uit, inclusief die met meerdere elektronen.
* Voorspelt chemische binding en moleculaire structuren.
* Neemt de golfdeeltjesdualiteit van elektronen op.
* Beperkingen:
* Zeer complex om het gedrag van elektronen precies te berekenen, vooral voor grote atomen.
Belangrijkste verschillen:
1. Elektronenbanen: Het BOHR -model toont elektronen in vaste cirkelvormige banen, terwijl het kwantummodel elektronen beschouwt als bestaande in regio's van de ruimte genaamd orbitalen met verschillende waarschijnlijkheidsverdelingen.
2. energieniveaus: BOHR -model kwantificeert energieniveaus als discrete stappen, maar het kwantummodel vertoont meer genuanceerde, overlappende energieniveaus binnen orbitalen (sablevel en schelpen).
3. Elektronengedrag: Het Bohr-model behandelt elektronen als deeltjes, terwijl het kwantummodel hun golfdeeltjesdualiteit herkent.
4. Voorspellende kracht: Het kwantummodel is nauwkeuriger en verklaart een breder scala aan fenomenen, inclusief chemische binding en moleculaire eigenschappen.
Samenvattend:
Het kwantummechanische model is een meer accurate en uitgebreide beschrijving van het atoom in vergelijking met het Bohr -model. Hoewel het Bohr-model een waardevolle opstap was, wordt het vervangen door het meer geavanceerde kwantummechanische raamwerk dat de complexiteit en golfachtige aard van elektronen weerspiegelt.
 Welke methode wordt gebruikt om een gas op te vangen?
Welke methode wordt gebruikt om een gas op te vangen?  Nieuwe strategie zet evolutie van microscopische structuren in een stroomversnelling
Nieuwe strategie zet evolutie van microscopische structuren in een stroomversnelling Vaccinontwerp kan immuuntherapieën voor kanker drastisch verbeteren
Vaccinontwerp kan immuuntherapieën voor kanker drastisch verbeteren Wat zijn vier kenmerken van natrium?
Wat zijn vier kenmerken van natrium?  Onderzoekers verbeteren katalysator die voor altijd chemicaliën vernietigt met zonlicht
Onderzoekers verbeteren katalysator die voor altijd chemicaliën vernietigt met zonlicht
 Overmatige regen veroorzaakte 2018 vulkaanuitbarsting Kīlauea, studie vondsten
Overmatige regen veroorzaakte 2018 vulkaanuitbarsting Kīlauea, studie vondsten Superkoralen identificeren door middel van DNA-analyse
Superkoralen identificeren door middel van DNA-analyse Machine learning voorspelt nieuwe details van geothermische warmtestroom onder de Groenlandse ijskap
Machine learning voorspelt nieuwe details van geothermische warmtestroom onder de Groenlandse ijskap De regering van Biden stelt voor het recht van Californië te herstellen om regels voor autovervuiling vast te stellen
De regering van Biden stelt voor het recht van Californië te herstellen om regels voor autovervuiling vast te stellen Mensen zien slechts 4,7 km in de verte. Dus hoe kunnen we echt begrijpen wat de bosbranden hebben vernietigd?
Mensen zien slechts 4,7 km in de verte. Dus hoe kunnen we echt begrijpen wat de bosbranden hebben vernietigd?
Hoofdlijnen
- Hoe diabetes werkt
- Waarom analyseren wetenschappers resultaten van experimenten?
- Experimenten tonen aan dat tuimelaars waarschijnlijk een episodisch geheugen hebben
- Wat is de wetenschappelijke classificatie van Linckia laevigata?
- Doodt klimaatverandering Amerikaanse zeesterren?
- Wat zijn de vier belangrijkste methoden voor het produceren van ATP?
- Zal de paling het beheer ervan overleven?
- Haaien evolueerden vliegtuigachtige attributen om in habitats te passen
- Wat zijn allelparen van een organisme?
- Onderzoekers voegen orde toe aan polymeergels

- Microreactor voor synthese met Grignard-reagentia

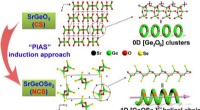
- Nieuwe gedeeltelijke isovalente inductiestrategie voor anionsubstitutie om infrarood niet-lineaire optische materialen te ontwerpen
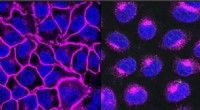
- Wetenschappers bepalen de structuur van glasvormend eiwit in sponzen

- Chemici maken moleculaire scalpels om ongewenste eiwitten van celoppervlakken te verwijderen
 Vergeet Obamageddon, Preppen maakt nu deel uit van de reguliere Amerikaanse politiek en cultuur
Vergeet Obamageddon, Preppen maakt nu deel uit van de reguliere Amerikaanse politiek en cultuur Nieuwe techniek helpt bij het onderzoeken van de atomaire structuur van complexe oppervlakken
Nieuwe techniek helpt bij het onderzoeken van de atomaire structuur van complexe oppervlakken Welke drie soorten weefsels zijn er in planten?
Welke drie soorten weefsels zijn er in planten?  Facebook, Instagram introduceert tijdmanagementtools
Facebook, Instagram introduceert tijdmanagementtools RMSD berekenen
RMSD berekenen  NASA vindt dat tropische cycloon Diane snel vervaagt
NASA vindt dat tropische cycloon Diane snel vervaagt UC-les:Niemand wint bij een aardverschuiving
UC-les:Niemand wint bij een aardverschuiving Magic Trap behoudt de kwantumcoherentie in ultrakoude moleculen langer dan verwacht
Magic Trap behoudt de kwantumcoherentie in ultrakoude moleculen langer dan verwacht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

