
Wetenschap
Wat is de vergelijking die dissociatie vertegenwoordigt in de oplossing van zout gevormd bij een driewaardig kation en bivalent anion?
Algemene weergave
* kation: M
3+
(waarbij M het metaal vertegenwoordigt)
* anion: X
2-
(waarbij x het niet-metaal vertegenwoordigt)
Dissociatie -vergelijking
De algemene vergelijking voor de dissociatie van een dergelijk zout is:
M 2 X 3 (s) → 2m
3+
(aq) + 3x
2-
(aq)
Verklaring
* M 2 X 3 (s): Dit vertegenwoordigt het vaste zout voordat het oplost.
* →: Dit geeft het dissociatieproces aan.
* 2m
3+
(aq): Dit toont de twee drievoudige kationen (m
3+
) die worden vrijgegeven in de oplossing, voorgesteld door (aq) voor waterig.
* 3x
2-
(aq): Dit toont de drie bivalente anionen (x
2-
) die in de oplossing worden vrijgegeven.
Voorbeeld
Laten we het voorbeeld nemen van aluminiumoxide (Al 2 O 3 ):
Al 2 O 3 (s) → 2al
3+
(aq) + 3o
2-
(aq)
belangrijke opmerkingen:
* De subscripts in de chemische formule (bijv. 2 en 3 in Al 2 O 3 ) Geef de verhouding van kationen tot anionen in het zout aan.
* De coëfficiënten in de gebalanceerde vergelijking (bijv. 2 en 3 in de dissociatievergelijking) vertegenwoordigen het aantal ionen dat wordt vrijgegeven per formule -eenheid van het zout.
* Dit is een vereenvoudigde weergave. Het werkelijke dissociatieproces kan hydrateren van de ionen door watermoleculen in de oplossing.
 Hoe de Glow in the Dark te maken Chemical
Hoe de Glow in the Dark te maken Chemical Hoe kunnen zowel biotische een abiotische elementen die betrokken zijn bij de stikstofcyclus?
Hoe kunnen zowel biotische een abiotische elementen die betrokken zijn bij de stikstofcyclus?  Polonium heeft een atoomnummer van 84. Hoeveel protonen en elektronen heeft het?
Polonium heeft een atoomnummer van 84. Hoeveel protonen en elektronen heeft het?  Het perspectief op de oorsprong van enzymatische katalytische kracht veranderen
Het perspectief op de oorsprong van enzymatische katalytische kracht veranderen Is het een chemische reactie als je maar koper in vuur en zwart wordt?
Is het een chemische reactie als je maar koper in vuur en zwart wordt?
 Wat kunnen Charleston en andere kuststeden Zuid-Florida leren over de stijging van de zeespiegel?
Wat kunnen Charleston en andere kuststeden Zuid-Florida leren over de stijging van de zeespiegel?  23 jaar waterkwaliteitsgegevens van gewas-veesystemen
23 jaar waterkwaliteitsgegevens van gewas-veesystemen Hoe komt zure regen in de watercyclus?
Hoe komt zure regen in de watercyclus?  Studie:Waterverlies door droogte veroorzaakte stijging van Sierra Nevada
Studie:Waterverlies door droogte veroorzaakte stijging van Sierra Nevada Wat is een proces waarbij een ecosysteem zichzelf kan vernieuwen?
Wat is een proces waarbij een ecosysteem zichzelf kan vernieuwen?
Hoofdlijnen
- Wat zijn de classificaties van ampicilline?
- Wetenschappers leggen uit hoe diverse soorten naast elkaar bestaan in microbiële gemeenschappen
- Wat is de wetenschappelijke definitie van een onafhankelijke variabele?
- Welke genen zijn cruciaal voor de energiestofwisseling van Archaea?
- Welke cel bevat chloroplasten die chlorofyl heeft?
- Sommige planten worden groter - en gemener - als ze worden geknipt, studie vondsten
- Droogte decimeert de belangrijkste katoenoogst in Texas
- Wat is de term die vrij betekent van microben in het menselijk lichaam?
- Hoe wetenschappers het Cheerios-effect omkeerden
- Noodzaak van rigoureuze procedures binnen de elektrochemische productie van ammoniak

- Chemici maken sneller afbreekbaar plastic voor gebruik op zee
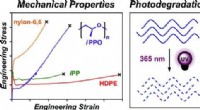
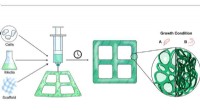
- Naar aanpasbaar hout, gekweekt in een laboratorium
- Onderzoekers biosynthetiseren antikankerverbinding gevonden in giftige Australische boom

- Weg van plastic:het geval van solid body wash

 Monitoring van luchtvervuiling door branden
Monitoring van luchtvervuiling door branden Geleidend papier kan toekomstige flexibele elektronica mogelijk maken
Geleidend papier kan toekomstige flexibele elektronica mogelijk maken Zullen de levens van Amerikaanse studenten voor altijd worden getransformeerd door COVID-19?
Zullen de levens van Amerikaanse studenten voor altijd worden getransformeerd door COVID-19? Hoe ANOVA te berekenen met de hand
Hoe ANOVA te berekenen met de hand Wat is het belangrijkste mineraal dat in de botmatrix wordt aangetroffen?
Wat is het belangrijkste mineraal dat in de botmatrix wordt aangetroffen?  Kunstmatige intelligentie leren om zintuigen zoals zien en aanraken te verbinden
Kunstmatige intelligentie leren om zintuigen zoals zien en aanraken te verbinden Nieuwe inzichten over werk, spanning, en politieke vaardigheden
Nieuwe inzichten over werk, spanning, en politieke vaardigheden Wat maakt binding tussen metalen mogelijk?
Wat maakt binding tussen metalen mogelijk?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

