
Wetenschap
Onderzoekers biosynthetiseren antikankerverbinding gevonden in giftige Australische boom

Stekende Boom in het verre noorden van Queensland. Krediet:Rainer Wunderlich, CC BY-SA 3.0
De Australische steekboom (Dendrocnide moroides) is een plant die veel mensen koste wat kost vermijden. De boom, die lid is van de brandnetelfamilie, is bedekt met dunne siliconen naalden die zijn doorspekt met een van de meest ondraaglijke gifstoffen van de natuur, een stof genaamd moroidin. "Het is berucht omdat het extreme pijn veroorzaakt, die heel lang blijft hangen", zegt Jing-Ke Weng, lid van het Whitehead Institute.
Er is echter een andere kant aan moroidin; naast het veroorzaken van pijn, bindt de verbinding zich aan de cytoskeletten van cellen, waardoor ze niet kunnen delen, waardoor moroidin een veelbelovende kandidaat is voor chemotherapiemedicijnen.
Het is om voor de hand liggende redenen moeilijk gebleken om genoeg van de chemische stof te oogsten om te bestuderen. Nu, in een paper gepubliceerd op 19 april in het Journal of the American Chemical Society , Weng, die ook universitair hoofddocent biologie is aan het Massachusetts Institute of Technology (MIT) en voormalig postdoc Roland Kersten, nu een assistent-professor aan het University of Michigan College of Pharmacy, presenteren de eerste gepubliceerde methode om moroidin in de weefsels te biosynthetiseren van onschadelijke planten zoals tabak, waardoor onderzoek naar het nut van de verbinding voor kankerbehandelingen wordt vergemakkelijkt.
Een blad uit het plantenboek halen om peptiden te maken
Moroidin is een bicyclisch peptide - een type molecuul dat bestaat uit bouwstenen die aminozuren worden genoemd en die cirkelvormig zijn gemaakt om twee verbonden ringen te bevatten. Voor synthetische chemici is het bijna onmogelijk gebleken om moroidin te synthetiseren vanwege de complexe chemische structuur. Weng en Kersten wilden dieper ingaan op de methoden die de planten gebruikten om dit molecuul te maken.
In plantencellen worden cyclische peptiden gemaakt van specifieke voorlopereiwitten die worden gesynthetiseerd door het ribosoom, de macromoleculaire machine die eiwitten produceert door boodschapper-RNA's te vertalen. Na het verlaten van het ribosoom worden deze voorlopereiwitten verder verwerkt door andere enzymen in de cel om aanleiding te geven tot de uiteindelijke cyclische peptiden. In 2018 hadden Weng en Kersten het biosynthetische mechanisme opgehelderd van een ander type plantaardige peptiden, lyciumines genaamd, die voor het eerst werden gevonden in de gojibesplant, waardoor ze enig inzicht kregen in hoe post-translationele modificaties een rol kunnen spelen bij het creëren van verschillende soorten plantpeptide chemie. "We hebben veel geleerd over de belangrijkste elementen van dit systeem door lyciuminen te bestuderen," zei Weng.
Toen ze begonnen te onderzoeken hoe moroidin werd gesynthetiseerd, ontdekten de onderzoekers dat een paar andere planten, zoals Kerria japonica en Celosia argentea, ook peptiden produceren met een vergelijkbare chemie als moroidin. "Dat gaf ons echt het zeer kritische inzicht dat dit een nieuwe klasse van peptiden is," zei Weng.
Weng en Kersten ontdekten eerder dat het BURP-domein, dat deel uitmaakt van de voorlopereiwitten voor lyciuminen en verschillende andere cyclische peptiden van planten, sleutelreacties katalyseert die betrokken zijn bij de vorming van peptideringen. Ze ontdekten dat het BURP-domein aanwezig was in de voorlopereiwitten voor moroidins in Kerria japonica, en leek essentieel voor het creëren van de twee-ringstructuur van de moleculen. Het BURP-domein creëert ringchemie in de aanwezigheid van koper, en toen de onderzoekers het moroidin-precursoreiwit in het laboratorium samen met andere stroomafwaartse proteolytische enzymen incubeerden met koperchloride, waren ze in staat om moroidin-achtige peptiden te creëren.
Met deze informatie waren ze in staat om een verscheidenheid aan moroidin-analogen in tabaksplanten te produceren door het moroidin-precursorgen van Kerria japonica transgene tot expressie te brengen en de kernmotiefsequentie te variëren die overeenkomt met moroidin-peptiden. "We laten zien dat je dezelfde moroidine-chemie in een andere waardplant kunt produceren," zei Weng. "Tabak zelf is gemakkelijker op grote schaal te kweken, en we denken ook dat we in de toekomst een plantencellijn kunnen afleiden uit de bestaande tabakscellijnen die we in het moroidin-precursorpeptide stoppen, dan kunnen we de cellijn gebruiken om het molecuul produceren, wat ons echt in staat stelt om op te schalen voor de productie van medicijnen."
Toekomstig gebruik van moroidin
De antikankereigenschap van Moroidin is, althans gedeeltelijk, te danken aan de unieke structuur van de verbinding waardoor het zich kan binden aan een eiwit dat tubuline wordt genoemd. Tubuline vormt een skelet voor levende cellen en verschaft de middelen waarmee cellen hun chromosomen scheiden terwijl ze zich voorbereiden op deling. Momenteel werken twee bestaande geneesmiddelen tegen kanker, vincristine en paclitaxel, door tubuline te binden. Deze twee verbindingen zijn ook afkomstig van planten (respectievelijk de maagdenpalm van Madagaskar en de taxus uit de Stille Oceaan).
In hun nieuwe werk synthetiseerden Weng en Kersten een moroïdine-analoog genaamd celogentin C. Ze testten de antikankeractiviteit ervan tegen een menselijke longkankercellijn en ontdekten dat de verbinding giftig was voor de kankercellen. Hun nieuwe studie suggereert ook mogelijk nieuwe antikankermechanismen die specifiek zijn voor deze longkankercellijn naast tubuline-remming.
In het verleden zijn onderzoekers tegen problemen aangelopen bij het maken van effectieve medicijnen van peptiden. "Er zijn twee grote uitdagingen voor peptiden als medicijn," zei Weng. "Aan de ene kant zijn ze niet erg stabiel in vivo, en aan de andere kant zijn ze niet erg biologisch beschikbaar en passeren ze niet gemakkelijk het membraan van een cel."
Maar cyclische peptiden zoals moroidin en zijn analogen zijn een beetje anders. "Deze peptiden evolueren in wezen om medicijnachtig te zijn," zei Weng. "In het geval van de Australische steekboom zijn de peptiden aanwezig omdat de planten alle dieren willen afschrikken die de bladeren willen eten. Dus gedurende miljoenen jaren van evolutie hebben deze planten uiteindelijk een manier gevonden om deze specifieke cyclische peptiden te construeren die zijn stabiel, biologisch beschikbaar en kunnen bij het dier komen dat de planten probeert op te eten."
Het is waarschijnlijk dat de pijnlijke reactie die optreedt wanneer moroidin het lichaam binnendringt via een steek van de boom, geen probleem zou zijn bij traditionele methoden voor het toedienen van chemotherapie. "De pijn wordt echt veroorzaakt als je injecties van de verbinding in de huid krijgt," zei Weng. "Als je het oraal of intraveneus inneemt, zal je lichaam de pijn waarschijnlijk niet voelen."
Enigszins contra-intuïtief, zou de verbinding ook als pijnstiller kunnen worden gebruikt. "Als iets pijn veroorzaakt, kun je dat soms als pijnstiller gebruiken," zei Weng. "Je zou in wezen de pijnreceptoren kunnen uitputten, of als je de structuur een klein beetje verandert, zou je een agonist in een antagonist kunnen veranderen en mogelijk de pijn kunnen blokkeren."
Op een meer fundamenteel niveau zou moroidin onderzoekers kunnen helpen pijnreceptoren te bestuderen. "We weten niet precies waarom gestoken worden door de stekende boom die enorme hoeveelheid pijn veroorzaakt, en er kunnen extra pijnreceptoren zijn die mensen niet hebben geïdentificeerd," zei Weng. "Moroidin kunnen synthetiseren biedt een chemische sonde waarmee we deze onbekende pijnperceptie bij mensen kunnen bestuderen."
In de toekomst hopen de onderzoekers analogen van moroidin te maken om te bestuderen, en hopelijk een optimale versie te creëren voor gebruik bij kankertherapie. "We willen een bibliotheek van moroidin-achtige peptiden genereren," zei Weng. "We hebben dit gedaan voor lyciumines, en aangezien de initiële moroidines anti-tubuline-moleculen zijn, kunnen we dit systeem gebruiken om een verbeterde versie te vinden die nog sterker aan tubuline bindt en andere farmacologische eigenschappen bevat, waardoor het geschikt is om als therapeutisch middel te worden gebruikt." . + Verder verkennen
Screening op macrocyclische peptiden
 Hoe een 3D-model van Glucose
Hoe een 3D-model van Glucose Onderzoekers identificeren een metaal dat bestand is tegen ultrahoge temperatuur en druk
Onderzoekers identificeren een metaal dat bestand is tegen ultrahoge temperatuur en druk Drukverhoging is niet verantwoordelijk voor vervuiling van membranen, studie vondsten
Drukverhoging is niet verantwoordelijk voor vervuiling van membranen, studie vondsten Het polymerisatieproces in- en uitschakelen met een schakelbare sjabloon
Het polymerisatieproces in- en uitschakelen met een schakelbare sjabloon Een driedimensionaal atoomproject maken
Een driedimensionaal atoomproject maken
 Kunnen twee bedrijven in Georgië de plasticcrisis helpen oplossen?
Kunnen twee bedrijven in Georgië de plasticcrisis helpen oplossen? Studie richt zich op warmwaterringen die de orkaanintensivering in de Caribische Zee voeden
Studie richt zich op warmwaterringen die de orkaanintensivering in de Caribische Zee voeden NASA ziet ontwikkeling van tropische cycloon 3S langs de kust van West-Australië
NASA ziet ontwikkeling van tropische cycloon 3S langs de kust van West-Australië Firefall-fenomeen verbaast bezoekers aan Yosemites El Capitan
Firefall-fenomeen verbaast bezoekers aan Yosemites El Capitan Voet sneeuw bedekt delen van Midwest, verstoort het reizen (update)
Voet sneeuw bedekt delen van Midwest, verstoort het reizen (update)
Hoofdlijnen
- Kenmerken van nucleïnezuren
- Wetenschappers pleiten voor verbeterde technologieën om bedreigde Californische zalm te redden
- Hoe zijn cellen, weefsels en organen verwant?
- Een incubator laten groeien Bacteriën
- Is hangry een echte emotie?
- Leuke wetenschappelijke experimenten op cellen
- Hoeveel Valence-elektronen heeft natrium?
- RNA (ribonucleïnezuur): definitie, functie, structuur
- Je wandeling is zo duidelijk dat het diepe persoonlijkheidskenmerken kan onthullen
- Een nieuwe gouden standaardverbinding voor het opwekken van elektriciteit uit warmte

- De borstelharen van polyelektrolytborstels opfleuren en krimpen
- Nieuw productieproces voor polymeren bespaart 10 ordes van energie

- Type reacties met koper en salpeterzuur
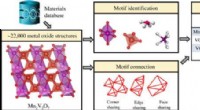
- Structuurmotiefgericht leerkader voor anorganische kristallijne systemen
 Beeldvormingstechniek maakt studies mogelijk naar de dynamiek van nanokatalysatoren bij ongekende ruimtelijke, tijdelijke resolutie
Beeldvormingstechniek maakt studies mogelijk naar de dynamiek van nanokatalysatoren bij ongekende ruimtelijke, tijdelijke resolutie Berekening van het statistische verschil
Berekening van het statistische verschil Lunar sample vertelt eeuwenoud verhaal door internationale samenwerking
Lunar sample vertelt eeuwenoud verhaal door internationale samenwerking Ontdekkingen in sensortechnologie bevorderen gepersonaliseerde geneeskunde
Ontdekkingen in sensortechnologie bevorderen gepersonaliseerde geneeskunde Leegstandbelasting kan effectiever zijn dan nieuwbouw om woningen betaalbaarder te maken
Leegstandbelasting kan effectiever zijn dan nieuwbouw om woningen betaalbaarder te maken Juridische strijd over rechten op naam Olympische oprichters
Juridische strijd over rechten op naam Olympische oprichters De inkomens van vrouwen verbeteren wanneer democraten een openbaar ambt bekleden, studie vondsten
De inkomens van vrouwen verbeteren wanneer democraten een openbaar ambt bekleden, studie vondsten oude munten, uit Roemenië geplunderde armbanden keren terug naar huis
oude munten, uit Roemenië geplunderde armbanden keren terug naar huis
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

