
Wetenschap
Het perspectief op de oorsprong van enzymatische katalytische kracht veranderen
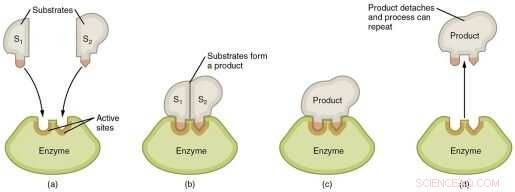
Grafische weergave van de stappen in een enzymatische reactie. Krediet:Wikimedia Commons
De enzymen die in levende organismen worden aangetroffen, hebben een indrukwekkende katalytische kracht. Dankzij enzymen gebeuren de chemische reacties die het leven in stand houden miljoenen keren sneller dan zonder enzymen. Enzymen versnellen reacties door te helpen de activeringsenergie te verlagen die nodig is om ze te starten, maar al meer dan 70 jaar is de manier waarop enzymen dit bereiken het onderwerp van hevig debat.
Dr. Tor Savidge, hoogleraar pathologie en immunologie aan het Baylor College of Medicine en het Texas Children's Microbiome Center, en zijn collega's veranderen de manier waarop naar dit oude argument wordt gekeken. In hun werk gepubliceerd in Chemical Science , onderzochten ze de overeenkomsten en verschillen tussen de twee mechanismen die momenteel ter discussie staan door katalytische reacties op een gedetailleerd moleculair niveau te karakteriseren.
"Op dit moment worden twee belangrijke verschillende reactiemechanismen voorgesteld om enzymatische katalytische kracht te verklaren," zei Savidge. "De ene stelt voor dat enzymen de activeringsenergie van de reactie verlagen via stabilisatie van overgangstoestanden (TS) en de andere dat ze dit doen door de grondtoestand (GS) van enzymen te destabiliseren. Het huidige idee is dat deze mechanismen elkaar uitsluiten."
Eerste auteur Dr. Deliang Chen van de Gannan Normal University in China en zijn collega's hebben een theoretische benadering gevolgd, rekening houdend met eerdere bevindingen van het Savidge-lab waaruit blijkt dat de niet-covalente interacties van substraten en enzymen met water belangrijk zijn in termen van het mechanisme van de enzymatische reacties.
"In een biologische omgeving moet je rekening houden met het water - dat het gaat interfereren met de zeer complexe atomaire interacties die plaatsvinden in de actieve plaats van het enzym. We moeten ze allemaal overwegen om te begrijpen waar je precies elektrostatische interacties moet hebben die zijn dat enzymatische proces zal bevorderen," zei Savidge. "Als je daar rekening mee houdt, kun je begrijpen hoe deze mechanismen werken."
Hun analyses brachten het team ertoe iets nieuws voor te stellen:dat TS en GS toch niet zo verschillend zijn. Ze gebruiken een soortgelijk atomair mechanisme om de enzymatische reactie naar voren te stimuleren. Het mechanisme houdt in dat water de lading van belangrijke residuen in de katalytische plaats verandert op een manier die de vorming van een energetisch gunstige toestand bevordert die de enzymatische reactie stimuleert.
"Het belangrijke, nieuwe punt hier is niet hoe dit wordt bereikt, maar wanneer het wordt bereikt", zei Savidge. "We hebben aangetoond dat bij stabilisatie van overgangstoestanden de ladingen die de reactie voortstuwen, worden gevormd voordat het substraat de actieve plaats binnengaat. In de destabilisatiegrondtoestand gebeurt dit ook, maar nadat het substraat de actieve plaats binnengaat." P>
De onderzoekers stelden ook voor dat het gemeenschappelijke mechanisme tussen TS en GS universeel is; het kan op veel enzymatische reacties worden toegepast.
Hun bevindingen hebben belangrijke implicaties, niet alleen om onderzoekers te helpen de katalytische kracht van enzymen beter te begrijpen, maar ook voor praktische toepassingen voor het ontwerpen van geneesmiddelen.
"We gebruiken onze bevindingen om microbiële enzymatische katalyse in verschillende omgevingen dieper te onderzoeken en om kunstmatige enzymen te ontwerpen," zei Savidge.
Yibao Li, Xun Li, Xiaolin Fan, aan de Gannan Normal University, en Xuechuan Hong aan de Wuhan University School of Pharmaceutical Sciences hebben ook bijgedragen aan dit werk. + Verder verkennen
Elektrische velden in kaart brengen om te helpen ontrafelen hoe enzymen werken
 Gedetailleerd beeld van een moleculaire toxinetransporter
Gedetailleerd beeld van een moleculaire toxinetransporter Cactuswortels inspireren tot creatie van waterhoudend materiaal
Cactuswortels inspireren tot creatie van waterhoudend materiaal Verankerd door een dichte buurt:wat voorkomt dat cellen afdwalen?
Verankerd door een dichte buurt:wat voorkomt dat cellen afdwalen? Nieuwe materialen helpen volumetrisch 3D-printen uit te breiden
Nieuwe materialen helpen volumetrisch 3D-printen uit te breiden De gevoelige spanningssensor die het gewicht van een veer kan detecteren
De gevoelige spanningssensor die het gewicht van een veer kan detecteren
 Roly-Poly Bug Facts
Roly-Poly Bug Facts Aardbevingswetenschap had de nucleaire klim van Noord-Korea kunnen voorspellen
Aardbevingswetenschap had de nucleaire klim van Noord-Korea kunnen voorspellen NASA-satelliet ontdekt windschering die tropische storm Francisco nadelig beïnvloedt
NASA-satelliet ontdekt windschering die tropische storm Francisco nadelig beïnvloedt Stranden verstikt met stinkend zeewier kunnen het nieuwe normaal zijn
Stranden verstikt met stinkend zeewier kunnen het nieuwe normaal zijn Grootschalig onderzoek:Congolese vissers melden achteruitgang van de visbestanden op het Tanganyikameer
Grootschalig onderzoek:Congolese vissers melden achteruitgang van de visbestanden op het Tanganyikameer
Hoofdlijnen
- Science Fair Project Ideas: Equine
- Cellulaire ademhaling bij de mens
- Drie voorbeelden van protisten met wetenschappelijke namen
- Voordelen en nadelen van klonen
- De Krebs-cyclus en de Homeostasis
- Beeldstabilisatie bij gewervelde dieren hangt af van contrast tussen objecten
- High School Biology Experiment Ideas
- Het unieke pentraxine-koolzuuranhydrase-eiwit reguleert het vermogen van vissen om te zwemmen
- Naarmate het klimaat warmer wordt, muizen morph
- Een nieuwe klasse membranen belooft interessante toepassingen in materiaalscheiding

- Programmeerbare druppelmanipulatie door een robot met magnetische activering

- Nieuwe methode detecteert snel sporen van kleine moleculen
- Onderzoek vindt een goede plek om betere cellulose-afbrekende enzymen te ontwikkelen

- Berekeningsanalyse ontrafelt het complexe gedrag van een polymeer

 Wat zijn de effecten van koken en bevriezen op de enzymactiviteit?
Wat zijn de effecten van koken en bevriezen op de enzymactiviteit?  Kunstmatige topologische materie opent nieuwe onderzoeksrichtingen
Kunstmatige topologische materie opent nieuwe onderzoeksrichtingen Slimme truc maakt 20 keer snellere beeldvorming mogelijk met elektronenmicroscopie
Slimme truc maakt 20 keer snellere beeldvorming mogelijk met elektronenmicroscopie Gedragsverschillen tussen Noord- en Zuid-Chinezen gekoppeld aan tarwe- en rijstteelt, studie toont
Gedragsverschillen tussen Noord- en Zuid-Chinezen gekoppeld aan tarwe- en rijstteelt, studie toont Een 5% NaCl-oplossing maken
Een 5% NaCl-oplossing maken Wat is een op afstand bediend spionagevliegtuig?
Wat is een op afstand bediend spionagevliegtuig?  Elektronische handschoen biedt menselijke eigenschappen voor gebruikers van prothesehanden
Elektronische handschoen biedt menselijke eigenschappen voor gebruikers van prothesehanden Ultra-hoge-energetische gammastraling is afkomstig van pulsarnevels
Ultra-hoge-energetische gammastraling is afkomstig van pulsarnevels
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

