
Wetenschap
Wat beschrijft het beste een ontledingsreactie?
Hier is een uitsplitsing:
* Eén reactant: De reactie begint met een enkele stof (de reactant).
* Meerdere producten: De reactant valt af in twee of meer verschillende stoffen (de producten).
* Energie -input: Ontledingsreacties vereisen meestal energie -input om de bindingen in het reactant -molecuul te verbreken. Deze energie kan in de vorm van warmte, licht of elektriciteit zijn.
Voorbeelden:
* elektrolyse van water: Water (H₂o) wordt ontleed in waterstofgas (H₂) en zuurstofgas (O₂) door er een elektrische stroom doorheen te geven.
* Verwarming van calciumcarbonaat: Calciumcarbonaat (CACO₃) ontleedt in calciumoxide (CaO) en koolstofdioxidegas (CO₂) wanneer verwarmd.
Sleutelpunten:
* Ontledingsreacties zijn het tegenovergestelde van synthesereacties, waarbij twee of meer stoffen samen een enkele verbinding vormen.
* Deze reacties zijn gebruikelijk in veel chemische processen, waaronder de afbraak van voedsel in ons lichaam en de productie van metalen uit ertsen.
 Wetenschappers ontwikkelen een nieuwe methode voor het kwantificeren van onzichtbare plastics in rivieren
Wetenschappers ontwikkelen een nieuwe methode voor het kwantificeren van onzichtbare plastics in rivieren  De effecten van bosbranden op bodemcondities
De effecten van bosbranden op bodemcondities Hypoxische dode zones gevonden in stedelijke stromen, niet alleen aan de kust
Hypoxische dode zones gevonden in stedelijke stromen, niet alleen aan de kust Wat zijn de kleuren die je ziet als je naar een groen blad kijk?
Wat zijn de kleuren die je ziet als je naar een groen blad kijk?  De regering-Biden wil de 320 kilometer lange Ambler-mijnweg door de wildernis van Alaska weigeren
De regering-Biden wil de 320 kilometer lange Ambler-mijnweg door de wildernis van Alaska weigeren
Hoofdlijnen
- Waarom gebruiken planten zuurstof bij kieming?
- Waar gaan microplastics naar de oceanen?
- Een analogie om uit te leggen waarom de celgrootte beperkt is?
- Welke voordelen heeft biologische landbouw voor de honingbijen?
- Hoe bacteriële cellen hun eigen DNA herkennen
- Wetenschappers ontdekken fundamentele regels voor de manier waarop het dengue-virus zijn muggen- en menselijke gastheren infecteert
- Is broccoli een fruitsteelbloem of wortel?
- Ingewikkelde ijsgrotten in Antarctica May Harbor Unique Life
- Hoe krijgen wetenschappers informatie?
- Menselijke membraaneiwitten zorgen voor een evolutionair evenwicht

- Een bioplastic op basis van soja-eiwit dat tot 40 keer zijn eigen gewicht kan opnemen

- Groene productie van chemicaliën voor de industrie

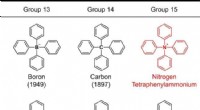
- Synthese van tetrafenylammonium:bevestiging van het bestaan van het fantoomion
- Onderzoekers ontdekken een nieuwe receptor die de functie van de voorlopercellen van de talgklier reguleert
 Wat is de rol van de overheid bij het veilig maken van het internet?
Wat is de rol van de overheid bij het veilig maken van het internet?  Doorbraak in robotica:wetenschappers maken kunstmatige huid
Doorbraak in robotica:wetenschappers maken kunstmatige huid Leg 2 manieren uit waarop technologie wordt gebruikt op het gebied van genetica?
Leg 2 manieren uit waarop technologie wordt gebruikt op het gebied van genetica?  Hoe een uitvinding te bedenken?
Hoe een uitvinding te bedenken?  De oppervlakte van een cirkel berekenen
De oppervlakte van een cirkel berekenen Holografisch beeld van een zwart gat voorgesteld in een grafeenvlok
Holografisch beeld van een zwart gat voorgesteld in een grafeenvlok Onderzoekers ontdekken nieuwe informatie over interstellair magnetisch veld in zonnewijk
Onderzoekers ontdekken nieuwe informatie over interstellair magnetisch veld in zonnewijk Review:Slimme horloges zijn veelbelovend, maar hebben werk nodig
Review:Slimme horloges zijn veelbelovend, maar hebben werk nodig
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

