
Wetenschap
Zal 1 mol suiker hetzelfde effect hebben als tafelzout bij het verlagen van het vriespuntwater?
* Colligatieve eigenschappen: Bevriezende puntdepressie is een colligatieve eigenschap, wat betekent dat het afhankelijk is van het * aantal * van opgeloste stofdeeltjes in een oplossing, niet op de chemische identiteit.
* dissociatie: Tafelzout (NaCl) is een ionische verbinding die dissocieert in twee ionen (Na+ en Cl-) wanneer opgelost in water. Suiker (sucrose) daarentegen is een moleculaire verbinding die niet distent.
* Effectieve concentratie: Daarom produceert 1 mol tafelzout 2 mol opgeloste deeltjes (ionen), terwijl 1 mol suiker slechts 1 mol opgeloste deeltjes produceert.
* Freezing Point Depression: Hoe groter het aantal opgeloste deeltjes, hoe groter de depressie van het vriespunt.
Samenvattend:
* 1 mol tafelzout zal het vriespunt van water verlagen meer dan 1 mol suiker omdat het tweemaal het aantal opgeloste deeltjes produceert.
 Hoe het glucoseniveau in Leaves
Hoe het glucoseniveau in Leaves Onderzoekers ontwikkelen duurzame wondverbandhydrogel op basis van zeewier en koolzuurhoudend water
Onderzoekers ontwikkelen duurzame wondverbandhydrogel op basis van zeewier en koolzuurhoudend water  Wetenschappers isoleren kankerstamcellen met behulp van nieuwe methode
Wetenschappers isoleren kankerstamcellen met behulp van nieuwe methode Video:Zijn ammoniakmotoren de weg van de toekomst?
Video:Zijn ammoniakmotoren de weg van de toekomst?  Waarom zouden de chemicaliën in meststoffen oplosbaar water zijn?
Waarom zouden de chemicaliën in meststoffen oplosbaar water zijn?
 Onkruidrobots:naar een boerderij bij jou in de buurt?
Onkruidrobots:naar een boerderij bij jou in de buurt? Nieuw-Zeeland investeert in de groei van zijn binnenlandse recyclingindustrie om banen te creëren en minder afval op stortplaatsen te dumpen
Nieuw-Zeeland investeert in de groei van zijn binnenlandse recyclingindustrie om banen te creëren en minder afval op stortplaatsen te dumpen Vaste waterplanten
Vaste waterplanten Van New York tot Chili, loodbesmettingsproject ontwikkelt burgerwetenschap
Van New York tot Chili, loodbesmettingsproject ontwikkelt burgerwetenschap Klimaatpatronen gekoppeld in Amazon, Noord- en Zuid-Amerika, studie toont
Klimaatpatronen gekoppeld in Amazon, Noord- en Zuid-Amerika, studie toont
Hoofdlijnen
- Je laat een microbe-vingerafdruk achter op elk kledingstuk dat je draagt – en het kan forensische wetenschappers helpen misdaden op te lossen
- Mariene robots detecteren walvissen in de diepe oceaan
- Platform op nanoschaal heeft tot doel de eiwitniveaus te beheersen
- Wat zijn de belangrijkste verschillen tussen plantencellen en dierlijke cellen?
- Welke colligatieve eigenschap is uiterst belangrijk voor het functioneren van levende organismen?
- Onderzoekers ontdekken hoe stamcellen hun identiteit kiezen
- Onderzoekers observeren hoe de flexibiliteit van een eiwitscharnier cruciaal is voor de overdracht van celeiwitten
- Het herstel van de kusthabitat verhoogt het aantal wilde dieren met 61%, maar door raadselachtige mislukkingen kunnen we het nog steeds beter doen
- Een natte winter kan de invasieve soorten van San Francisco Bay opschudden
- Ongebruikelijke nanodeeltjes kunnen de zoektocht naar een kwantumcomputer ten goede komen
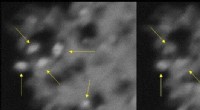
- Verbetering van de femtoseconde ultrakorte pulslaser

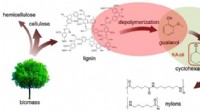
- Nieuw proces verandert papierproductieafval in waardevolle chemicaliën
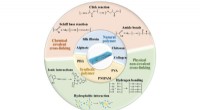
- Hydrogel bevordert wondgenezing beter dan traditionele zwachtels, gaasjes
- Stamcellen in bot veranderen met nanoklei-versterkte hydrogel

 Het Kondo-effect afstemmen, één molecuul tegelijk
Het Kondo-effect afstemmen, één molecuul tegelijk Sahara-stofwolk doemt op boven Cuba, Caraïben en Florida
Sahara-stofwolk doemt op boven Cuba, Caraïben en Florida NASA-satellietgegevens tonen de voortgang van het ozongat in Antarctica in 2009 (met video)
NASA-satellietgegevens tonen de voortgang van het ozongat in Antarctica in 2009 (met video)  Wat zorgt ervoor dat magneten elkaar soms aantrekken en tijden afstoten?
Wat zorgt ervoor dat magneten elkaar soms aantrekken en tijden afstoten?  Mechanica (Physics): The Study of Motion
Mechanica (Physics): The Study of Motion Hoe nieuwe vogelsoorten ontstaan
Hoe nieuwe vogelsoorten ontstaan  Waar is cyclone nargis gebeurd?
Waar is cyclone nargis gebeurd?  Een instrument dat wordt gebruikt om Earhtquake -golven op te nemen, wordt een genoemd?
Een instrument dat wordt gebruikt om Earhtquake -golven op te nemen, wordt een genoemd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

