
Wetenschap
Hoeveel gram ethyleen is nodig om te reageren met 0,132 mol H20?
Om het aantal gram ethyleen te berekenen dat nodig is om te reageren met 0,132 mol water (H2O), moeten we de uitgebalanceerde chemische vergelijking kennen voor de reactie tussen ethyleen (C2H4) en water.
De evenwichtige vergelijking is:
C2H4(g) + H2O(g) → C2H5OH(g)
Uit deze vergelijking kunnen we zien dat 1 mol ethyleen reageert met 1 mol water.
Daarom zijn de benodigde mol ethyleen gelijk aan het aantal mol water:
Mol ethyleen =Mol water =0,132 mol
Nu kunnen we mol ethyleen omzetten in grammen met behulp van de molaire massa:
Molaire massa van ethyleen (C2H4) =2(12,01 g/mol) + 4(1,008 g/mol) =28,05 g/mol
Gram ethyleen =Mol ethyleen × Molaire massa ethyleen
Gram ethyleen =0,132 mol x 28,05 g/mol
Gram ethyleen =3,70 gram (ongeveer)
Er is dus 3,70 gram ethyleen nodig om te reageren met 0,132 mol water.
 Arctische verandering heeft wijdverbreide gevolgen
Arctische verandering heeft wijdverbreide gevolgen Wat als de dinosaurussen niet waren uitgestorven? Waarom onze wereld er heel anders uit zou kunnen zien
Wat als de dinosaurussen niet waren uitgestorven? Waarom onze wereld er heel anders uit zou kunnen zien  Waarom bestaat de mens op aarde?
Waarom bestaat de mens op aarde?  Onderzoekers vinden onverwachte impact van orkanen op stroomgebied van Puerto Rico
Onderzoekers vinden onverwachte impact van orkanen op stroomgebied van Puerto Rico IJsland verandert koolstofdioxide in steen voor schonere lucht
IJsland verandert koolstofdioxide in steen voor schonere lucht
Hoofdlijnen
- Kunnen de meeste Amerikanen worden geïdentificeerd aan de hand van het DNA van een familielid? Misschien binnenkort
- Moleculaire atlas van een Australisch drakenbrein werpt nieuw licht op meer dan 300 miljoen jaar hersenevolutie
- Houden mannelijke vissen ze liever groot en kleurrijk?
- Welke antigenen zijn er in een menselijk lichaam?
- Fish and chips op Mars:Onderzoek toont aan hoe kolonisten hun eigen voedsel konden produceren
- De ascomyceten ontlenen hun naam aan welk aspect van de levenscyclus een vegetatieve groeivorm b aseksuele sporenproductie c seksuele structuren d vormen het e-type mycelium?
- Nieuwe technologie verandert de manier waarop eiwitten in individuele cellen worden bestudeerd
- Percepties van bewoners over de halsbandparkiet in Groot-Brittannië
- Wat wordt bedoeld met fitness in de darwinistische evolutie?
- Het pad van chemicaliën door de bodem volgen

- Computers strijden mee tegen COVID-19

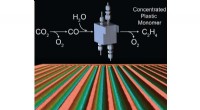
- Nieuw proces recyclet overtollige koolstofdioxide efficiënter tot brandstof, studie vondsten
- Efficiënte elektrochemische cellen voor CO2-conversie
- Directe elektrolyse heeft gemengde resultaten voor het extraheren van brandstofbronnen uit microalgen

 Handhaving effectiever dan financiële prikkels bij het terugdringen van schadelijke veenbranden?
Handhaving effectiever dan financiële prikkels bij het terugdringen van schadelijke veenbranden? Hoe werkte de pascalinemachine?
Hoe werkte de pascalinemachine?  De kracht van zwavel ontsluiten in toekomstig medicijnontwerp
De kracht van zwavel ontsluiten in toekomstig medicijnontwerp Vrouwen gebruiken roddels om te strijden om de aandacht van een man
Vrouwen gebruiken roddels om te strijden om de aandacht van een man RNA's verborgen potentieel:nieuwe studie onthult zijn rol in het vroege leven en toekomstige bio-engineering
RNA's verborgen potentieel:nieuwe studie onthult zijn rol in het vroege leven en toekomstige bio-engineering  Spray verven van vezelverbanden op wonden
Spray verven van vezelverbanden op wonden Onderzoekers ontwikkelen methode om detectie van infectieziekten te versnellen, kanker
Onderzoekers ontwikkelen methode om detectie van infectieziekten te versnellen, kanker Bent u bereid te betalen om videoclips online te bekijken?
Bent u bereid te betalen om videoclips online te bekijken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

