
Wetenschap
Waarom wordt de theoretische opbrengst van een reactie alleen bepaald door de hoeveelheid beperkende reactant?
De beperkende reactant is degene die aanwezig is in de kleinste molverhouding vergeleken met de andere reactanten. Dit kan worden bepaald door het aantal mol van elke reactant te delen door zijn stoichiometrische coëfficiënt in de uitgebalanceerde chemische vergelijking. De reactant met de kleinste molverhouding is de beperkende reactant.
Zodra de beperkende reactant is geïdentificeerd, kan de theoretische opbrengst worden berekend door het aantal mol van de beperkende reactant te vermenigvuldigen met de stoichiometrische coëfficiënt van het product in de uitgebalanceerde chemische vergelijking. Dit levert de maximale hoeveelheid product op die tijdens de reactie kan worden gevormd.
De werkelijke opbrengst van een reactie is gewoonlijk lager dan de theoretische opbrengst vanwege factoren zoals nevenreacties, onvolledige reacties en verliezen tijdens de zuivering. De theoretische opbrengst biedt echter een nuttig referentiepunt voor het evalueren van de efficiëntie van een reactie.
 Het wel en wee van een megameer
Het wel en wee van een megameer Dieetrichtlijnen zijn een win-win-win voor voeding, milieu en dieren
Dieetrichtlijnen zijn een win-win-win voor voeding, milieu en dieren NASA-vluchten detecteren miljoenen Arctische methaanhotspots
NASA-vluchten detecteren miljoenen Arctische methaanhotspots De mens bloeide in Zuid-Afrika door de Toba-supervulkaanuitbarsting rond 74, 000 jaar geleden
De mens bloeide in Zuid-Afrika door de Toba-supervulkaanuitbarsting rond 74, 000 jaar geleden De ineenstorting van het klimaat verhoogt in feite de economische waarde van de poolzeeën - pas op voor de zakelijke opportunisten
De ineenstorting van het klimaat verhoogt in feite de economische waarde van de poolzeeën - pas op voor de zakelijke opportunisten
Hoofdlijnen
- Als moeders de genen van de vader in plantenembryo's uitschakelen
- Nieuwe biobronnen voor plantaardige peptidehormonen met behulp van technologie voor het bewerken van genen
- In welk organel vindt cellulaire ademhaling plaats?
- Onderzoekers detecteren giftige chemicaliën in waterorganismen met een nieuwe AI-methode
- Mitosis: definitie, stadia en doel
- Wat octopus en menselijke hersenen gemeen hebben
- De ongelooflijke reis van de eerste Afrikaanse schildpad die in Europa aankwam
- Wat is de neurochemie van geluk?
- Wijzigingen in de Amerikaanse importregels voor honden:wat ze zijn en waarom belangrijk voor hondenmensen
- True to type:van menselijke biopsie tot complexe darmfysiologie op een chip
- Tungsten als interstellaire stralingsafscherming?
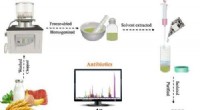
- Sporen van meerdere klassen antibiotica in voedingsmiddelen detecteren
- Video:Vaccin tegen coronavirus:waar zijn we en wat is de volgende stap?

- Hoe kathodische corrosie van metaalelektroden bij elektro-organische synthese te voorkomen?

 Wat zijn de tekens op een liniaal?
Wat zijn de tekens op een liniaal?  Zijn de blauwdrukken voor ledematen gecodeerd in het slangengenoom?
Zijn de blauwdrukken voor ledematen gecodeerd in het slangengenoom?  Metalen nanodeeltjes helpen bij het bepalen van het percentage vluchtige stoffen
Metalen nanodeeltjes helpen bij het bepalen van het percentage vluchtige stoffen Nanomedicijnen op weg door het lichaam
Nanomedicijnen op weg door het lichaam Hier is hoe Californië vuur kan gebruiken om zijn natuurbrandprobleem op te lossen
Hier is hoe Californië vuur kan gebruiken om zijn natuurbrandprobleem op te lossen Waar vond de oerknal plaats?
Waar vond de oerknal plaats?  Nieuw contract van $ 2,5 miljard toegekend om kernwapenlab te beheren
Nieuw contract van $ 2,5 miljard toegekend om kernwapenlab te beheren Voorbij seksrobots:Erobotics onderzoekt erotische mens-machine-interacties
Voorbij seksrobots:Erobotics onderzoekt erotische mens-machine-interacties
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

