
Wetenschap
True to type:van menselijke biopsie tot complexe darmfysiologie op een chip
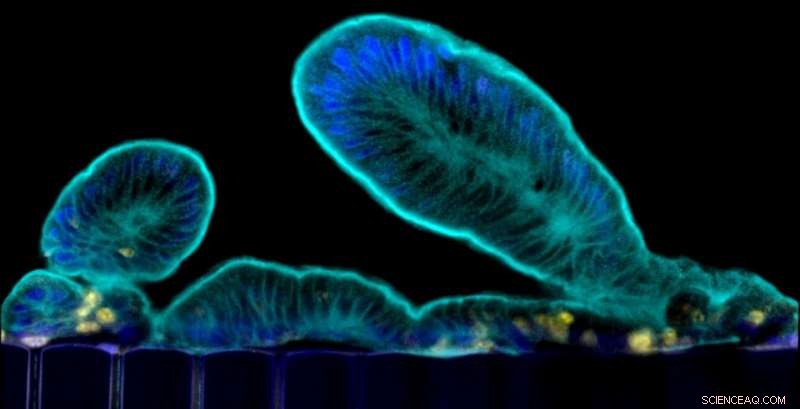
Villi-achtige extensies die primaire dunne darmcellen uitsteken in het lumen van het epitheelkanaal van de chip. Krediet:Wyss Institute aan de Harvard University
De dunne darm is de belangrijkste plaats waar we voedingsstoffen en mineralen uit voedsel verteren en opnemen, en het is ook een plaats waar veel darminfecties voorkomen en spijsverterings- en ontstekingsstoornissen zich manifesteren. Om de darm in zijn normale en pathologische toestand beter te begrijpen, onderzoekers hebben "organoïden" gecreëerd door darmstamcellen te isoleren van menselijke biopsiemonsters. Deze organoïden vormen alle celtypen die aanwezig zijn in de menselijke darm, maar ze groeien als cysten omgeven door dikke extracellulaire matrixgels met hun "apicale" celoppervlak (dat normaal wordt blootgesteld aan de inhoud van de darm) gericht naar een ingesloten lumen. Dit verhindert de studie van dynamische processen waarbij de darmbarrière betrokken is, inclusief transport van voedingsstoffen en medicijnen, evenals de interacties met het microbioom. In aanvulling, organoïden missen een vaatstelsel en de mechanische bewegingen veroorzaakt door normale peristaltiek en bloedstroom, die essentieel zijn voor veel processen in de darm, inclusief de regeneratie en controle van bacteriële overgroei.
In een poging om deze beperkingen te overwinnen, een team van het Wyss Institute for Biologically Inspired Engineering onder leiding van de oprichter, Donald Ingber, MD, doctoraat, eerder een microfluïdisch "Organ-on-a-Chip" (Organ Chip) kweekapparaat had ontwikkeld waarin cellen van een menselijke darmcellijn die oorspronkelijk uit een tumor was geïsoleerd, werden gekweekt in een van de twee parallel lopende kanalen, gescheiden door een poreus matrix-gecoat membraan van menselijke bloedvaten afgeleide endotheelcellen in het aangrenzende kanaal. Hoewel deze menselijke Gut Chip het villus-epitheel van de normale darm nabootste en nieuwe inzichten mogelijk maakte in hoe stroming en cyclische peristaltiek de darmdifferentiatie en -functie beïnvloeden, het kon niet worden gebruikt om processen te bestuderen die afhankelijk waren van normale darmcellen van individuele donoren, die, bijvoorbeeld, is cruciaal voor het bestuderen van patiëntspecifieke reacties op gepersonaliseerde geneeskunde.
In een nieuwe studie, gepubliceerd in Wetenschappelijke rapporten , Het team van Ingber verwijdert deze wegversperringen nu. "We zijn nu in staat om de organoïde benadering te gebruiken om darmstamcellen te isoleren uit menselijke biopsieën, maar we breken de organoïden af en kweken de patiëntspecifieke cellen in onze orgaanchips waar ze spontaan darmvlokken vormen die gericht zijn op het kanaallumen, en het epitheel in nauwe verbinding met het microvasculaire endotheel van de menselijke darm, " zei Inger, die ook de Judah Folkman Professor of Vascular Biology is aan de Harvard Medical School (HMS) en het Vascular Biology Program aan het Boston Children's Hospital, evenals hoogleraar bio-engineering aan de John A. Paulson School of Engineering and Applied Sciences (SEAS) van Harvard. "Deze aanpak vormt een nieuwe opstap voor het onderzoeken van normale en ziektegerelateerde processen op een zeer gepersonaliseerde manier, inclusief het transport van voedingsstoffen, spijsvertering, verschillende darmaandoeningen, en intestinale interacties met commensale microben en pathogenen."
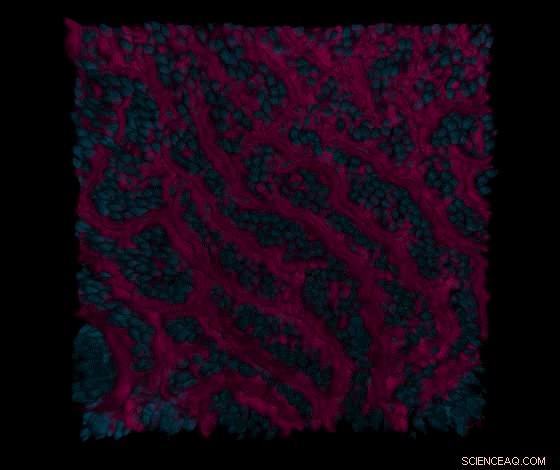
Een reeks confocale microscopiesecties genomen door de darmepitheel- en vasculaire kanalen van de primaire dunne darm-op-een-chip visualiseert eerst het oppervlak van epitheliale villi-achtige structuren (in rood) en kernen (in blauw) van dunne darmepitheelcellen in het darmkanaal, en vervolgens cel-celcontacten (in groen) van intestinale endotheelcellen in het aangrenzende vasculaire kanaal. Krediet:Wyss Institute aan de Harvard University
Het team werkte samen met het laboratorium van David Breault in het Boston Children's Hospital om een organoïde cultuurstap in hun procedure in te bouwen om normale darmstamcellen te isoleren en hun celaantallen te vergroten. De resulterende organoïden kunnen ofwel worden opgeslagen voor toekomstig gebruik of onmiddellijk worden gefragmenteerd en gezaaid in de "epitheliale" kanalen van meerdere orgaanchips, waar ze verder werden gerijpt door gespecialiseerd kweekmedium te laten stromen en mechanische stimulatie op de kanalen toe te passen om fysiologische peristaltiek-achtige bewegingen na te bootsen. De rijping van het epitheel tot een villus-intestinaal epitheel met lange vingerachtige verlengingen werd geholpen door het samen kweken van menselijke intestinale microvasculaire endotheelcellen aan de andere kant van het gedeelde met matrix gecoate poreuze membraan in het "vasculaire" kanaal waar ze een surrogaatbloed verzamelden vat met een hol lumen waardoor voedingsmedium werd gestroomd.
Dus, twee van de meest geavanceerde technologieën op het gebied van tissue engineering combineren? organoïde cultuur en orgelchips? maakte het mogelijk om darmweefsels en structuren op orgaanniveau te genereren, bekleed met menselijke donorspecifieke cellen met morfologie, samenstelling, en functie die sterk lijkt op die van het duodenumgebied van de normale dunne darm. "Omdat de primaire Dunne Darm Chip de fysieke micro-omgeving recapituleert die cellen in het menselijk lichaam ervaren, zoals vloeistofstroom en cyclische peristaltiek-achtige rekbewegingen, het vertoont een genoom-breed genexpressieprofiel dat dichter bij zijn in vivo tegenhanger komt dan dat van dezelfde darmcellen die worden gekweekt als 3D-organoïden, " zei eerste auteur Magdalena Kasendra, doctoraat, een voormalig postdoctoraal onderzoeker in het team van Ingber en nu hoofdwetenschapper bij Emulate, Inc. in Boston.
Samen met darmstamcellen, het team identificeerde gedifferentieerde nutriëntenverterende en absorberende enterocyten, slijmproducerende Goblet-cellen, hormoonafscheidende entero-endocriene cellen, en microbioom-regulerende en voelende Paneth-cellen, en ze voerden een reeks testen uit die hun functies bevestigden. Omdat de micro-omgeving van de dunne darm wekenlang kan worden gehandhaafd in continu geperfundeerde orgaanchips, ze maken zowel korte- als langetermijnstudies mogelijk waarvan de waarnemingen terug te voeren zijn op de gezondheid en fysiologie van individuele donoren.
Het team van Ingber past nu dezelfde benadering toe op verschillende delen van de darm:twaalfvingerige darm, jejunum, ileum, en dikke darm - waarvan de functies en ziektekwetsbaarheden van elkaar verschillen. Deze benadering wordt ook gebruikt om nog complexere darmomgevingen te reverse-engineeren door andere celtypen te integreren, zoals immuuncellen, neuronale cellen, en commensale microben in het apparaat. "In de toekomst, dergelijke inspanningen zouden ons in staat kunnen stellen om de interacties tussen mens en microbioom veel beter te begrijpen, modelondervoedingsstoornissen en ontstekingsziekten van de darm, en het uitvoeren van gepersonaliseerde drugstests, " zei mede-eerste auteur Alessio Tovaglieri, een afgestudeerde student aan de afdeling Gezondheidswetenschappen en Technologie aan de ETH Zürich in Zwitserland, die zijn afstudeerwerk uitvoert in het team van Ingber.
 Wat is de ideale gaswet?
Wat is de ideale gaswet?  Een voordelige aerogel op basis van legeringen als elektrokatalysator voor koolstoffixatie
Een voordelige aerogel op basis van legeringen als elektrokatalysator voor koolstoffixatie Nieuwe katalysatoren voor betere brandstofcellen
Nieuwe katalysatoren voor betere brandstofcellen Activering van koolstof-fluorbindingen door samenwerking van een fotokatalysator en tin
Activering van koolstof-fluorbindingen door samenwerking van een fotokatalysator en tin Enkele vingerafdruk op plaats delict detecteert klasse A-drugsgebruik
Enkele vingerafdruk op plaats delict detecteert klasse A-drugsgebruik
 De opwarming van het noordpoolgebied zal de klimaatverandering versnellen en de wereldeconomie beïnvloeden
De opwarming van het noordpoolgebied zal de klimaatverandering versnellen en de wereldeconomie beïnvloeden Slachtoffers van bosbranden in Californië zeggen dat schoonmaakploegen zorgen voor ellende
Slachtoffers van bosbranden in Californië zeggen dat schoonmaakploegen zorgen voor ellende De antropologie van klimaatverandering en terugtrekking van gletsjers
De antropologie van klimaatverandering en terugtrekking van gletsjers Tropische storm let op in Guam, NASA ziet 02W-vorm
Tropische storm let op in Guam, NASA ziet 02W-vorm Recycling van plastic - in Japanse stijl
Recycling van plastic - in Japanse stijl
Hoofdlijnen
- Wetenschap komt dichter bij het verklaren van de boze dronkaard
- Zeeschildpadden sterven nadat ze verstrikt zijn geraakt in plastic afval
- Het belang van samengestelde microscopen
- Wetenschappers ontwerpen bacteriën om sonarsignalen te reflecteren voor ultrasone beeldvorming
- Hoe bacteriën met zout te doden
- Hoe zijn dieren en planten vergelijkbaar?
- Een keep-fit gadget voor uw hond deze kerst - wie heeft er echt baat bij?
- Onderzoekers vinden lage genetische diversiteit bij gedomesticeerde fretten
- Iran verhuist om laatste mascotte Aziatische cheeta's te redden
 Chemicus verkent nanotechnologie op zoek naar goedkopere zonnecellen
Chemicus verkent nanotechnologie op zoek naar goedkopere zonnecellen Wetenschappers koken nieuw elektronisch materiaal
Wetenschappers koken nieuw elektronisch materiaal Ingenieurs creëren een inhaleerbare vorm van boodschapper-RNA
Ingenieurs creëren een inhaleerbare vorm van boodschapper-RNA De druk is weg en de supergeleiding op hoge temperatuur blijft
De druk is weg en de supergeleiding op hoge temperatuur blijft Onbekend terrein terwijl bosbranden woeden in het oosten van Australië
Onbekend terrein terwijl bosbranden woeden in het oosten van Australië draaikolk, de sleutel tot informatieverwerkingscapaciteit:Virtueel fysiek reservoir computing
draaikolk, de sleutel tot informatieverwerkingscapaciteit:Virtueel fysiek reservoir computing Vroege handelsroutes in de Indische Oceaan brengen kip, zwarte rat naar Oost-Afrika
Vroege handelsroutes in de Indische Oceaan brengen kip, zwarte rat naar Oost-Afrika Tweederde van de Afro-Amerikanen kent iemand die door de politie is mishandeld, en 22% meldt mishandeling in het afgelopen jaar
Tweederde van de Afro-Amerikanen kent iemand die door de politie is mishandeld, en 22% meldt mishandeling in het afgelopen jaar
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com






