
Wetenschap
Hoe beïnvloedt ionische binding de eigenschappen van verbindingen?
1. Kristalstructuur: Ionische verbindingen vormen doorgaans kristallen met een zeer geordende en regelmatige rangschikking van ionen. Deze opstelling wordt aangedreven door de elektrostatische aantrekkingskracht tussen positief geladen kationen en negatief geladen anionen, wat leidt tot de vorming van ionische kristallen.
2. Smelt- en kookpunten: Ionische verbindingen hebben over het algemeen hoge smelt- en kookpunten vanwege de sterke elektrostatische krachten die de ionen bij elkaar houden. Het overwinnen van deze krachten vereist een aanzienlijke hoeveelheid energie, wat resulteert in hogere smelt- en kookpunten.
3. Oplosbaarheid: Ionische verbindingen vertonen een variërende oplosbaarheid in verschillende oplosmiddelen. Ze zijn over het algemeen oplosbaar in polaire oplosmiddelen, zoals water, omdat de polaire oplosmiddelmoleculen kunnen interageren met de geladen ionen en het ionenrooster kunnen afbreken. Ionische verbindingen zijn echter meestal onoplosbaar in niet-polaire oplosmiddelen zoals hexaan, die de noodzakelijke polariteit missen om de ionische aantrekkingskracht te overwinnen.
4. Elektrische geleidbaarheid: In hun vaste toestand zijn ionische verbindingen slechte elektriciteitsgeleiders, omdat de ionen op vaste posities binnen het kristalrooster worden vastgehouden. Wanneer ze echter worden opgelost in water of gesmolten, dissociëren ionische verbindingen zich in vrije ionen, waardoor ze kunnen bewegen en een elektrische lading kunnen dragen, waardoor ze in deze toestanden goede elektriciteitsgeleiders zijn.
5. Hardheid: Vanwege de sterke ionische bindingen zijn ionische verbindingen vaak hard en bros. De stijve kristalstructuur en de moeilijkheid bij het verbreken van de ionische bindingen dragen bij aan hun hardheid. Deze stijfheid maakt ze echter ook gevoelig voor breuk of breuk onder mechanische belasting.
6. Chemische reactiviteit: Ionische verbindingen nemen voornamelijk deel aan chemische reacties door ionenuitwisseling of de vorming van nieuwe ionische bindingen. Ze kunnen verschillende reacties ondergaan, zoals neerslag, zuur-base-reacties en redoxreacties, afhankelijk van de aard van de betrokken ionen.
7. Hygroscopiciteit: Sommige ionische verbindingen vertonen hygroscopiciteit, wat betekent dat ze gemakkelijk vocht uit de atmosfeer absorberen. Deze eigenschap wordt vaak waargenomen in ionische verbindingen die kleine en sterk geladen ionen bevatten, die een hoge affiniteit voor watermoleculen hebben.
Het begrijpen van de eigenschappen van ionische binding is essentieel voor het voorspellen van het gedrag en de toepassingen van ionische verbindingen op verschillende gebieden, zoals scheikunde, materiaalkunde, techniek en farmacie.
 Elektronencryomicroscopie:goedkope technologie gebruiken om afbeeldingen met een hoge resolutie te maken
Elektronencryomicroscopie:goedkope technologie gebruiken om afbeeldingen met een hoge resolutie te maken Goed verbonden door amiden
Goed verbonden door amiden Voorbeelden van Atomen, Elementen en Isotopen
Voorbeelden van Atomen, Elementen en Isotopen  De transformatie van een geavanceerd synthetisch tussenproduct in een hele familie van natuurlijk voorkomende moleculen
De transformatie van een geavanceerd synthetisch tussenproduct in een hele familie van natuurlijk voorkomende moleculen Koolstofequivalent van API 5L GrB-materiaal?
Koolstofequivalent van API 5L GrB-materiaal?
 Toekomstige weersvoorspelling - het zit allemaal in de MRI van wolken
Toekomstige weersvoorspelling - het zit allemaal in de MRI van wolken Waarschuwing voor Davos:wereldslaapwandelen in klimaatramp
Waarschuwing voor Davos:wereldslaapwandelen in klimaatramp Net als China, Japan en de VS blijven buitenlandse energietechnologieën op basis van fossiele brandstoffen financieren
Net als China, Japan en de VS blijven buitenlandse energietechnologieën op basis van fossiele brandstoffen financieren Australië verlaagt vooruitzichten voor Great Barrier Reef naar zeer slecht
Australië verlaagt vooruitzichten voor Great Barrier Reef naar zeer slecht Tanzaniet is de echte blauwe diamant van Afrika
Tanzaniet is de echte blauwe diamant van Afrika
Hoofdlijnen
- Waarom zijn er zo weinig vissen in de oceanen van de aarde?
- Hoe een extra-klok ultradiaanse hersenoscillator de circadiane tijdwaarneming ondersteunt
- Maatregelen voor welzijn en duurzaamheid heroverwegen van lokale naar mondiale schaal
- Een stap dichter bij het begrijpen waarom sommige hagedissen immuun zijn voor het gif van zwarte weduwen
- Wat zijn de drie componenten van een DNA-molecuul?
- Openbare bronnen stimuleren de ontdekking van medicijnen en bieden inzicht in de eiwitfunctie
- Een andere massale verblekingsgebeurtenis verwoest het Great Barrier Reef. Wat is er nodig om koraal te laten overleven?
- Proof-of-concept onderzoek laat zien hoe humane insuline kan worden aangemaakt in koemelk
- Landbouw en meststoffen:hoe ecologische praktijken een verschil kunnen maken
- Het onderwaterleven belooft wat voor het doden van tuberculose

- Snelheidsvoorspelling voor homogene nucleatie van methaanhydraat
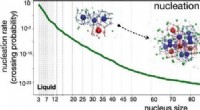
- Slim bulkplastic reageert op licht, temperatuur en vochtigheid

- Nieuwe ontdekking helpt autoriteiten de herkomst van heroïne te achterhalen

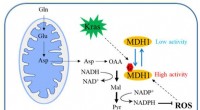
- Wetenschappers identificeren O-GlcNAcylatie als oorzaak van pancreastumorgroei door MDH1 te reguleren
 De geboorte van een gigantische planeet? Kandidaat-protoplaneet gespot in zijn stellaire baarmoeder
De geboorte van een gigantische planeet? Kandidaat-protoplaneet gespot in zijn stellaire baarmoeder  Hoe de wiskunde van deeltjesversnellers mij heeft geholpen mijn wifi te repareren
Hoe de wiskunde van deeltjesversnellers mij heeft geholpen mijn wifi te repareren  Ruimte voor klimaat
Ruimte voor klimaat Saffieren laten hun ware aard zien:niet waterminnend
Saffieren laten hun ware aard zien:niet waterminnend  Hittegolf annuleert lessen voor de helft van de Pakistaanse schoolkinderen
Hittegolf annuleert lessen voor de helft van de Pakistaanse schoolkinderen  Waar gaat Nintendo na Pokemon heen?
Waar gaat Nintendo na Pokemon heen?  Kooldioxide voedt planten, maar raken de aardse planten vol?
Kooldioxide voedt planten, maar raken de aardse planten vol? Messenger RNA wordt gelezen in groepen van drie. Hoe noemen we deze groepen?
Messenger RNA wordt gelezen in groepen van drie. Hoe noemen we deze groepen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

