
Wetenschap
Wat gebeurt er als zwavel reageert met heet en geconcentreerd zwavelzuur?
S + 2H2SO4 → 3SO2 + 2H2O
Bij deze reactie worden zwavelatomen (S) geoxideerd van een oxidatietoestand van nul naar een oxidatietoestand van +4 in zwaveldioxide (SO2), terwijl de waterstofatomen (H) in zwavelzuur (H2SO4) worden gereduceerd van een oxidatietoestand van +1. naar een nuloxidatietoestand in water (H2O).
Zwaveldioxidegas komt vrij als een kleurloos gas met een scherpe geur. De hete en geconcentreerde zwavelzuuroplossing dient zowel als reactant als als reactiemedium en biedt de noodzakelijke omstandigheden voor de oxidatie van zwavel. Deze reactie wordt vaak gebruikt bij de industriële productie van zwaveldioxide, dat vervolgens wordt gebruikt in verschillende toepassingen, zoals de raffinage van aardolie, de productie van papier en als bleekmiddel in de textielindustrie.
 In rampen wakker, nieuwe computertechnieken ondersteunen hulpdiensten
In rampen wakker, nieuwe computertechnieken ondersteunen hulpdiensten Manieren om onze niet-hernieuwbare en hernieuwbare bronnen te beheren
Manieren om onze niet-hernieuwbare en hernieuwbare bronnen te beheren  Eikenbomen in steden in het zuiden van de VS zijn natuurlijke stedelijke luchtfilters
Eikenbomen in steden in het zuiden van de VS zijn natuurlijke stedelijke luchtfilters Brits cruiseschip beschadigt ongerept Indonesisch koraalrif
Brits cruiseschip beschadigt ongerept Indonesisch koraalrif Frankrijk stopt met de productie van fossiele brandstoffen
Frankrijk stopt met de productie van fossiele brandstoffen
Hoofdlijnen
- Hoe lijken klonen op eeneiige tweelingen?
- Wat is de zuurstofroute als we inademen?
- Welke van de volgende is het meest waarschijnlijk het gevolg van een organisme met lipiden in zijn lichaam?
- Wat is de functie van mitochondriën in eukayotische organismen?
- Een diercel-diagram maken
- Hoe goede bacteriën je genen beheersen
- Onderzoeken hoe bryofyten zich aanpassen zonder gibberelline
- In de genetische code codeert een groep van drie stikstofbasen voor a?
- Geen zoetekauw meer? De wetenschap schakelt het verlangen naar suiker bij muizen uit
- Waterstofauto's voor de massa een stap dichter bij de realiteit, dankzij UCLA-uitvinding

- Polaroids helpen wetenschappers gevaarlijk ijs op vliegtuigplaten te detecteren

- Vooruitgang in het begrip van volledig solid-state batterijen
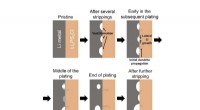
- De eigenschappen van een nieuwe klasse brillen voorspellen
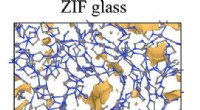
- Speciaal blauw licht - onderzoeker ontdekt dat nieuwe chemische clusters zeer efficiënt licht uitstralen

 Meerdere laboratoriumanalyses van Antarctische mineralen geven een beter begrip van Mars
Meerdere laboratoriumanalyses van Antarctische mineralen geven een beter begrip van Mars Het Deep-time Digital Earth-programma:gegevensgestuurde ontdekking in geowetenschappen
Het Deep-time Digital Earth-programma:gegevensgestuurde ontdekking in geowetenschappen Deskundige ziektedetective ontrafelt mysterieuze ziekte die de beroemde 12e-eeuwse sultan heeft gedood
Deskundige ziektedetective ontrafelt mysterieuze ziekte die de beroemde 12e-eeuwse sultan heeft gedood Dit is wat we weten over hoe klimaatverandering orkanen veroorzaakt
Dit is wat we weten over hoe klimaatverandering orkanen veroorzaakt Hoe werkt papierchromatografie en waarom scheiden pigmenten op verschillende punten?
Hoe werkt papierchromatografie en waarom scheiden pigmenten op verschillende punten?  Bandieten verliezen hun interesse in het beroven van banken, omdat sommige misdaden niet langer lonen
Bandieten verliezen hun interesse in het beroven van banken, omdat sommige misdaden niet langer lonen  Wat is de wetenschappelijke classificatie van de Anopheles-mug?
Wat is de wetenschappelijke classificatie van de Anopheles-mug?  Wie roept de vrouwenhaat en misbruik op die de academische vrijheid van vrouwen op onze universiteiten ondermijnen?
Wie roept de vrouwenhaat en misbruik op die de academische vrijheid van vrouwen op onze universiteiten ondermijnen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

