
Wetenschap
Waarom vormen elementen ionische en/of covalente bindingen?
1. Ionische bindingen:
Ionische bindingen ontstaan wanneer er een significant verschil in elektronegativiteit tussen atomen is, wat leidt tot de overdracht van elektronen van het ene atoom naar het andere. Dit resulteert in de vorming van positief geladen ionen (kationen) en negatief geladen ionen (anionen). Ionische bindingen worden doorgaans gevormd tussen metalen en niet-metalen. Bijvoorbeeld:
- Natrium (Na) en Chloor (Cl) vormen een ionische binding om NaCl (natriumchloride) te creëren, waarbij Na een elektron verliest aan Cl, wat resulteert in Na+ en Cl- ionen.
2. Covalente obligaties:
Covalente bindingen ontstaan wanneer atomen vergelijkbare elektronegativiteiten hebben en elektronen delen in plaats van ze volledig over te dragen. Dit type binding treedt op wanneer het verschil in elektronegativiteit tussen atomen relatief klein is. Covalente bindingen worden meestal gevonden tussen niet-metalen of tussen metalloïden en niet-metalen. Bijvoorbeeld:
- Waterstof (H) en waterstof (H) vormen een covalente binding om H2 (diwaterstof) te creëren, waarbij elk atoom het ene elektron met het andere deelt.
3. Polaire covalente bindingen:
Polaire covalente bindingen komen voor wanneer het elektronegativiteitsverschil tussen atomen niet significant genoeg is voor volledige elektronenoverdracht, maar nog steeds voldoende is om een lichte onbalans in het delen van elektronen te creëren. Dit resulteert in de gedeeltelijke ladingen op de atomen, waarbij het meer elektronegatieve atoom een lichte negatieve lading krijgt en het minder elektronegatieve atoom een lichte positieve lading krijgt. Bijvoorbeeld:
- Waterstof (H) en chloor (Cl) vormen een polaire covalente binding in HCl (waterstofchloride), waarbij Cl een sterkere aantrekkingskracht op elektronen uitoefent, waardoor een gedeeltelijk negatieve lading op Cl en een gedeeltelijk positieve lading op H ontstaat.
Samenvattend vormen elementen ionische en covalente bindingen op basis van hun elektronegativiteiten. Ionische bindingen omvatten elektronenoverdracht en resulteren in de vorming van ionen, terwijl covalente bindingen het delen van elektronen tussen atomen inhouden. Polaire covalente bindingen treden op wanneer er sprake is van een gedeeltelijke verdeling van elektronen als gevolg van een klein verschil in elektronegativiteit.
 Bruine koolstof van aromatische verontreinigende stoffen wordt uitgestoten tijdens verbranding en bosbranden
Bruine koolstof van aromatische verontreinigende stoffen wordt uitgestoten tijdens verbranding en bosbranden Cementvrij beton verslaat corrosie en geeft fatbergs de flush
Cementvrij beton verslaat corrosie en geeft fatbergs de flush Algoritme van natuurkundigen voorspelt de optische eigenschappen van moleculen
Algoritme van natuurkundigen voorspelt de optische eigenschappen van moleculen 2D-kristallen die voldoen aan 3D-curven veroorzaken spanning voor technische kwantumapparaten
2D-kristallen die voldoen aan 3D-curven veroorzaken spanning voor technische kwantumapparaten Welke polyatomaire ionen binden zich met andere om een ionische binding te vormen?
Welke polyatomaire ionen binden zich met andere om een ionische binding te vormen?
 Zet je schrap, ontkenners van klimaatverandering:het coronavirus maakt de overgang naar een koolstofarme economie urgenter
Zet je schrap, ontkenners van klimaatverandering:het coronavirus maakt de overgang naar een koolstofarme economie urgenter Hoe stille milieuactivisten de biodiversiteit kunnen helpen beschermen
Hoe stille milieuactivisten de biodiversiteit kunnen helpen beschermen Waarschuwingsborden van Storms
Waarschuwingsborden van Storms Rijkere landen moeten meer doen om diegenen te helpen die al met de klimaatcrisis te maken hebben
Rijkere landen moeten meer doen om diegenen te helpen die al met de klimaatcrisis te maken hebben Kenia is slecht voorbereid op overstromingen:vier stappen om verwoestingen en sterfgevallen te verminderen
Kenia is slecht voorbereid op overstromingen:vier stappen om verwoestingen en sterfgevallen te verminderen
Hoofdlijnen
- Welke methode gebruiken wetenschappers om identieke nakomelingen te maken uit volwassen cellen?
- De 3D-structuur van het genoom bepaalt hoe genen tot expressie worden gebracht
- Hoe lijken mitochondriën en chloroplasten op bacteriën?
- Welke sierplanten presteren het beste voor bestuivers?
- Netwerkassemblage door celdeling:hoe zenuwcellen in de hersenen verbinding maken tijdens de ontwikkeling
- Hoe jagen spinnen tegelijk?
- Wat doet acetonalcohol met een gramkleuring?
- Het verschil tussen craniologie en frenologie
- Wetenschappers onthullen hoe bacteriën huizen bouwen in gezonde cellen
- Stabiliserende eigenschappen van vurengom kunnen worden aangepast met behulp van extractietechnieken

- Bij kamertemperatuur gebonden interface verbetert de koeling van galliumnitride-apparaten

- Directe waarneming van coherentie-energieschaal van Hunds-metaal

- Onderzoekers kijken naar de natuur om de geheimen van cyclische imine-splitsing te ontrafelen
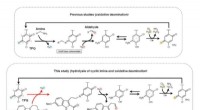
- Nobelprijswinnaar voor scheikunde zegt dat de eerste hindernis angst voor het donker was

 Aarde vanuit de ruimte:het Noordereiland van Nieuw-Zeeland
Aarde vanuit de ruimte:het Noordereiland van Nieuw-Zeeland  Zonnecel met zes knooppunten vestigt twee wereldrecords voor efficiëntie
Zonnecel met zes knooppunten vestigt twee wereldrecords voor efficiëntie De VS staan aan de vooravond van een hausse aan offshore windenergie. Waarom kapitaliseren bedrijven dit niet?
De VS staan aan de vooravond van een hausse aan offshore windenergie. Waarom kapitaliseren bedrijven dit niet?  Roep van de schelp:Archeologen suggereren dat inheemse Amerikanen geluid gebruikten om lokale gemeenschappen te organiseren
Roep van de schelp:Archeologen suggereren dat inheemse Amerikanen geluid gebruikten om lokale gemeenschappen te organiseren  Circulaire economie kan de winstgevendheid van windenergie verbeteren - en vice versa
Circulaire economie kan de winstgevendheid van windenergie verbeteren - en vice versa Nanobellen plus chemotherapie zijn gelijk aan eencellige kankertargeting
Nanobellen plus chemotherapie zijn gelijk aan eencellige kankertargeting Wetenschappers hebben voor het eerst excitonen in nikkeloxide gevonden
Wetenschappers hebben voor het eerst excitonen in nikkeloxide gevonden Wat heeft Albert Einstein uitgevonden?
Wat heeft Albert Einstein uitgevonden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

