
Wetenschap
Wat is het oxidatiegetal van N?
1. -3 (Nitride):Stikstof vertoont een oxidatiegetal van -3 in verbindingen waarbij het een drievoudige binding vormt met een metaal, wat resulteert in de vorming van nitride-ionen (N^3-). Bijvoorbeeld in natriumnitride (Na3N).
2. +1 (Ammonium en Hydroxylamine):Stikstof heeft een oxidatiegetal van +1 in verbindingen zoals ammoniumzouten (NH4+), waar het gebonden is aan vier waterstofatomen. Het vertoont ook een oxidatietoestand van +1 in hydroxylamine (NH2OH).
3. +2 (Hydrazine en Diazonium):In hydrazine (N2H4) vertoont stikstof een oxidatiegetal van +2. Bovendien heeft stikstof een oxidatietoestand van +2 in diazoniumzouten (RN2+).
4. +3 (Hydrazoëzuur):Stikstof heeft een oxidatiegetal van +3 in waterstofzuur (HN3), waar het een covalente binding vormt met drie waterstofatomen.
5. +4 (Stikstofdioxide, Nitraat):In stikstofdioxide (NO2) en nitraationen (NO3-) heeft stikstof een oxidatiegetal van +4, wat aangeeft dat het vier elektronen heeft verloren of vier bindingen heeft met meer elektronegatieve atomen.
6. +5 (Salpeterzuur, stikstofverbindingen):Stikstof vertoont een oxidatiegetal van +5 in salpeterzuur (HNO3) en nitroverbindingen (R-NO2), waar het covalente bindingen vormt met zuurstofatomen en gebonden is aan een koolstofatoom .
Het is belangrijk op te merken dat het oxidatiegetal van stikstof kan variëren in verschillende verbindingen en contexten. De werkelijke oxidatietoestand van stikstof in een specifieke verbinding of molecuul moet worden bepaald op basis van de chemische binding ervan en de verdeling van elektronen.
 Invasieve regenwormen aan de basis van de achteruitgang van suikeresdoorn
Invasieve regenwormen aan de basis van de achteruitgang van suikeresdoorn Kolonie-kenmerken van E.Coli
Kolonie-kenmerken van E.Coli Vulkaanuitbarsting Guatemala neemt af na overhaaste evacuaties
Vulkaanuitbarsting Guatemala neemt af na overhaaste evacuaties Het maken van mysterieuze doolhoven:hoe dieren hun complexe kleuringen kregen
Het maken van mysterieuze doolhoven:hoe dieren hun complexe kleuringen kregen  Sneeuw boven Antarctica bufferde zeespiegelstijging vorige eeuw
Sneeuw boven Antarctica bufferde zeespiegelstijging vorige eeuw
Hoofdlijnen
- Bloem of vlees? Genetica verklaart de voorkeur van muggen
- Ideeën voor de dingen Kinderen kunnen met een microscoop bekijken
Kinderen zijn vaak nieuwsgierig naar de wereld om hen heen. Een manier om deze nieuwsgierigheid aan te moedigen, is om ze een manier te bieden om de natuur op een nieuwe en intensiev
- Welke nucleotidesequentie zou de complementaire DNA-streng vertegenwoordigen die volgt op een g c t c?
- Hoe eiwitten in gist communiceren om partners te vinden
- Duwen of trekken? Hoeveel mariene organismen zwemmen er?
- Wetenschappers onthullen superbugs-artillerie
- Waarom migreren walvissen? Ze keren terug naar de tropen en werpen hun huid af, zeggen wetenschappers
- Het ontwikkelen van een symbiotische relatie tussen E. coli en stinkwantsen onthult aanwijzingen over hoe symbiose zich ontwikkelt
- Eenvoudig diermodel laat zien hoe omgeving en toestand zijn geïntegreerd om gedrag te beheersen
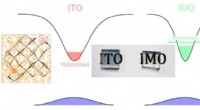
- Wetenschappers ontwerpen ontdekking verdubbelt geleidbaarheid van indiumoxide transparante coatings
- Een nieuw proces voor volledig gebruik van zachthoutschors

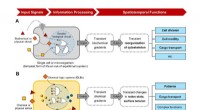
- Chemisch-logische systemen onderzoeken die kunnen reageren op omgevingscondities
- Het vinden van nieuwe biogebaseerde producten uit lignine zou kunnen helpen om van plastic af te komen

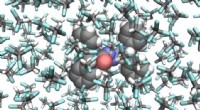
- Onderzoekers maken een fotografische film van een moleculaire schakelaar
 Dankzij ultrascherpe beelden zien oude sterren er fantastisch uit
Dankzij ultrascherpe beelden zien oude sterren er fantastisch uit Talos rapporteert over nieuwe, geavanceerde hackgroep die DNS-systemen manipuleert
Talos rapporteert over nieuwe, geavanceerde hackgroep die DNS-systemen manipuleert Een microscoop in een microscoop
Een microscoop in een microscoop Bronnen van de Lactase Enzyme
Bronnen van de Lactase Enzyme Mnemonic Devices voor het onthouden van de fasen van de maan
Mnemonic Devices voor het onthouden van de fasen van de maan  Twitter voegt waarschuwingen toe aan regelovertredende tweets van publieke figuren
Twitter voegt waarschuwingen toe aan regelovertredende tweets van publieke figuren Eclipse weersvoorspelling:Beste in West, minst in het Oosten
Eclipse weersvoorspelling:Beste in West, minst in het Oosten Nieuwe methode om te bepalen hoe resistent rivieren zijn tegen droogte
Nieuwe methode om te bepalen hoe resistent rivieren zijn tegen droogte
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

