
Wetenschap
27,0 ml 0,45 m naoh wordt geneutraliseerd door 20 an hcl-oplossing, de molariteit is?
NaOH + HCl → NaCl + H2O
Om de molariteit van de HCl-oplossing te bepalen, kunnen we de formule gebruiken:
Mol HCl =Molariteit van NaOH × Volume van NaOH (in liters)
Eerst moeten we het volume NaOH omrekenen van milliliter (ml) naar liter (L):
Volume NaOH =27,0 ml =0,027 l
Nu kunnen we het aantal mol HCl berekenen:
Mol HCl =0,45 M × 0,027 L =0,01215 mol
Vervolgens moeten we het volume van de HCl-oplossing vinden dat reageerde met de 0,01215 mol HCl. Laten we aannemen dat het volume van de HCl-oplossing V liter is.
Molariteit van HCl =Mol HCl / Volume HCl (in liters)
0,20 M =0,01215 mol/V
Als we V oplossen, krijgen we:
V =0,01215 mol / 0,20 M =0,06075 L
Daarom is de molariteit van de HCl-oplossing 0,20 M en het volume van de HCl-oplossing dat nodig is voor neutralisatie is 0,06075 l of 60,75 ml.
 Als een element elektronen krijgt, welk type oxidatiegetal heeft het dan en hoe weet je dat?
Als een element elektronen krijgt, welk type oxidatiegetal heeft het dan en hoe weet je dat?  Waarom is het raadzaam om geen natriummetaal op uw hand te smeren?
Waarom is het raadzaam om geen natriummetaal op uw hand te smeren?  Behouden stoffen in een mengsel hun eigen eigenschappen?
Behouden stoffen in een mengsel hun eigen eigenschappen?  Ondersteunde vloeibare metaalkatalysatoren - een nieuwe generatie reactieversnellers
Ondersteunde vloeibare metaalkatalysatoren - een nieuwe generatie reactieversnellers In het laboratorium gekweekte hoorns en slagtanden zouden kunnen stoppen met stropen - of niet
In het laboratorium gekweekte hoorns en slagtanden zouden kunnen stoppen met stropen - of niet
 Een langeafstandsverbinding:het poolklimaat beïnvloedt de passaatwindkracht in de tropen
Een langeafstandsverbinding:het poolklimaat beïnvloedt de passaatwindkracht in de tropen Onderzoek onderzoekt oorzaken van zeespiegeldalingen in de Dode Zee
Onderzoek onderzoekt oorzaken van zeespiegeldalingen in de Dode Zee Wat is er zo speciaal aan een dinosaurus genaamd Leonardo?
Wat is er zo speciaal aan een dinosaurus genaamd Leonardo?  Onderzoek naar de gevolgen van klimaatverandering door middel van populaire spreekwoorden
Onderzoek naar de gevolgen van klimaatverandering door middel van populaire spreekwoorden Palmolie:Minder kunstmest en geen herbicide maar dezelfde opbrengst?
Palmolie:Minder kunstmest en geen herbicide maar dezelfde opbrengst?
Hoofdlijnen
- Er zwerven nog steeds ruim 2 miljoen gazellen over de Mongoolse steppe
- Neem er een voor het team:hoe bacteriën zichzelf vernietigen om virale infecties te bestrijden
- Commensalisme: definitie, types, feiten en voorbeelden
- Waarom de verkeerde etikettering van de mondiale Rode Lijst een risico vormt voor veel soorten
- Geuren detecteren aan de rand:Onderzoekers ontcijferen hoe insecten meer ruiken met minder
- Wetenschappers ontdekken fundamentele regels voor de manier waarop het dengue-virus zijn muggen- en menselijke gastheren infecteert
- Nieuw inzicht in hoe de krachtcentrale van cellen zich deelt
- Bacteriën op afstand houden in Hawaiiaanse wateren
- 5 manieren om geluk te maximaliseren
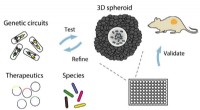
- Onderzoekers ontwikkelen nieuw platform dat kanker in een schaal nabootst om snel de beste bacteriële therapie te bepalen
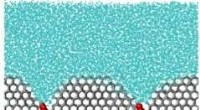
- methaanthiol, een potentiële nieuwe grondstof in de C1-chemie

- LED's maken de weg vrij voor betere medicamenteuze therapieën

- Polymeren te hulp! Cellen beschermen tegen beschadiging van ijs
- Peulvruchten opgewekt als nieuwe studie geheimen onthult van de plant die mensen kalm houdt

 Wat vier decennia zalm in blik onthullen over de voedselketens in de zee
Wat vier decennia zalm in blik onthullen over de voedselketens in de zee  Slow media:hoe het debat te vernieuwen in het tijdperk van digitaal autoritarisme
Slow media:hoe het debat te vernieuwen in het tijdperk van digitaal autoritarisme Automatisch chloreren van water bij openbare kranen vermindert kinderdiarree met bijna een kwart in stedelijk Bangladesh
Automatisch chloreren van water bij openbare kranen vermindert kinderdiarree met bijna een kwart in stedelijk Bangladesh Afvalbrandstof uit steenkool kan antropogene emissies verminderen, studie onthult
Afvalbrandstof uit steenkool kan antropogene emissies verminderen, studie onthult Nanodeeltjes genaamd C-dots tonen het vermogen om celdood in tumoren te induceren
Nanodeeltjes genaamd C-dots tonen het vermogen om celdood in tumoren te induceren  Nieuw onderzoek toont verband aan tussen klimaat en het vermogen van de aarde om zichzelf aan te vullen
Nieuw onderzoek toont verband aan tussen klimaat en het vermogen van de aarde om zichzelf aan te vullen Elektronische wol om draagbare technologie van de catwalk naar je garderobe te brengen
Elektronische wol om draagbare technologie van de catwalk naar je garderobe te brengen De geschiedenis van de CPT-stelling opnieuw bekijken
De geschiedenis van de CPT-stelling opnieuw bekijken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

