
Wetenschap
Waarom geleidt kaliumchloride elektriciteit in vaste toestand, maar is het in gesmolten toestand een goede geleider?
In vast KCl worden de ionen bij elkaar gehouden door sterke elektrostatische krachten. Deze krachten voorkomen dat de ionen bewegen, waardoor de verbinding geen elektriciteit kan geleiden. Wanneer KCl in water wordt opgelost, omringen de watermoleculen de ionen en breken ze de elektrostatische krachten af. Hierdoor kunnen de ionen vrij bewegen en wordt de verbinding een goede geleider van elektriciteit.
Hetzelfde gebeurt wanneer KCl wordt gesmolten. De hitte van het smeltproces breekt de elektrostatische krachten tussen de ionen af, waardoor ze vrij kunnen bewegen en elektriciteit kunnen geleiden.
Het verschil in geleidbaarheid tussen vast en gesmolten KCl is te wijten aan het verschil in de mobiliteit van de ionen. In de vaste toestand zijn de ionen onbeweeglijk en kunnen ze geen elektriciteit geleiden. In gesmolten toestand zijn de ionen mobiel en kunnen ze elektriciteit geleiden.
 Waarom fungeert een waterige oplossing van ammoniak als een zwakke base?
Waarom fungeert een waterige oplossing van ammoniak als een zwakke base?  Wetenschappers berekenen kristalstructuur van superharde molybdeenboriden
Wetenschappers berekenen kristalstructuur van superharde molybdeenboriden Hoe potentieel schadelijke vrije radicalen in sigarettenrook te meten
Hoe potentieel schadelijke vrije radicalen in sigarettenrook te meten  Met welk type elektronen hebben ionische bindingen te maken?
Met welk type elektronen hebben ionische bindingen te maken?  Onderzoekers kraken mengsels van oplosmiddelen puzzel
Onderzoekers kraken mengsels van oplosmiddelen puzzel
 Behandeld hydraulisch brekend afvalwater kan waterbronnen in de omgeving jarenlang vervuilen
Behandeld hydraulisch brekend afvalwater kan waterbronnen in de omgeving jarenlang vervuilen EPA-regel beperkt HFK's scherp, gassen gebruikt als koelmiddel
EPA-regel beperkt HFK's scherp, gassen gebruikt als koelmiddel Aangezien Californië naar verwachting binnen 20 jaar 10% van zijn water zal verliezen, roept regering Newsom op tot dringende actie
Aangezien Californië naar verwachting binnen 20 jaar 10% van zijn water zal verliezen, roept regering Newsom op tot dringende actie Welk type uil eet slangen?
Welk type uil eet slangen?  Ecosystems in Missouri
Ecosystems in Missouri
Hoofdlijnen
- Hoeveel morfemen zitten er in het woord biosfeer?
- Onderzoekers identificeren fundamentele eigenschappen van cellen die van invloed zijn op de vorming van weefselstructuren
- Metabolisme kan worden onderverdeeld in de volgende fasen?
- Wordt diffusie van water osmose genoemd?
- Wat gebeurt er met je cellen als je uitgedroogd bent?
- Druk jezelf uit:hoe zygoten ingeprent genen uitzoeken
- Bacteriën en virussen infecteren onze cellen via suikers:nu willen onderzoekers weten hoe ze dat doen
- Wat betekent organsim?
- De menselijke botgrootte en -structuur zijn het resultaat van de omgeving en?
- Waterdichte capsules voor doelgerichte toediening van medicijnen

- Handheld DNA-sequencers zijn veelbelovend voor het monitoren van microben tijdens voedselproductie

- Nieuwe oplosmiddelen om plantaardige cellulose af te breken voor bio-ethanol
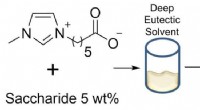
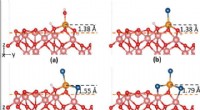
- Supercomputermodellen beschrijven de rol van chloriden bij corrosie
- Fluorescerende moleculen onthuld door kwantumchemie en machine learning

 Nieuwe nanodeeltjestechnologie vermindert waterverbruik, energiekosten
Nieuwe nanodeeltjestechnologie vermindert waterverbruik, energiekosten Verbeterde materialen voor hi-res patronen om micro-elektronica vooruit te helpen
Verbeterde materialen voor hi-res patronen om micro-elektronica vooruit te helpen Delhi zet zich schrap voor vervuiling airpocalypse als smog opdoemt
Delhi zet zich schrap voor vervuiling airpocalypse als smog opdoemt Komt het pre-pandemische kantoorleven ooit terug?
Komt het pre-pandemische kantoorleven ooit terug? Een stap dichter bij het kwantuminternet door distillatie
Een stap dichter bij het kwantuminternet door distillatie Een witte dwerg die op de rand leeft
Een witte dwerg die op de rand leeft Het verschil tussen staafdiagrammen en lijndiagrammen
Het verschil tussen staafdiagrammen en lijndiagrammen  Internationaal team bestudeert laatste onbekende grote rivierdelta ter wereld
Internationaal team bestudeert laatste onbekende grote rivierdelta ter wereld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

