
Wetenschap
Waarom fungeert een waterige oplossing van ammoniak als een zwakke base?
De reactie tussen ammoniak en water kan worden weergegeven door de volgende vergelijking:
NH3 + H2O ⇌ NH4+ + OH-
De evenwichtsconstante voor deze reactie is:
Kb =[NH4+][OH-]/[NH3]
Bij 25°C is Kb =1,8 × 10^-5. Dit betekent dat voor elke mol ammoniak die in water oplost, slechts 1,8 x 10^-5 mol ammoniumionen en hydroxide-ionen worden geproduceerd.
De kleine hoeveelheid hydroxide-ionen die wordt geproduceerd, is voldoende om de oplossing basisch te maken. Dit komt omdat hydroxide-ionen sterke basen zijn en ze volledig kunnen dissociëren in water om waterstofionen (H+) en hydroxide-ionen te vormen. De waterstofionen die worden geproduceerd door de dissociatie van hydroxide-ionen reageren met water en vormen hydroniumionen (H3O+). Hydroniumionen zijn verantwoordelijk voor de zuurgraad van oplossingen.
De pH van een waterige ammoniakoplossing kan worden berekend met behulp van de volgende vergelijking:
pH =14 - pOH
De pOH van een waterige ammoniakoplossing kan worden berekend met behulp van de volgende vergelijking:
pOH =-log[OH-]
Bij 25°C is de pH van een 0,1 M ammoniakoplossing 11,63. Dit betekent dat de oplossing basisch is.
 Waaruit bestaat de suikerverbinding?
Waaruit bestaat de suikerverbinding?  Hoe kattenkruid de chemische stof maakt die ervoor zorgt dat katten gek worden
Hoe kattenkruid de chemische stof maakt die ervoor zorgt dat katten gek worden  Ontwikkeling van een nieuwe techniek voor het kweken van hoogwaardige galliumnitridekristallen
Ontwikkeling van een nieuwe techniek voor het kweken van hoogwaardige galliumnitridekristallen Video:Hortensia's, de vreemde van kleur veranderende bloemen
Video:Hortensia's, de vreemde van kleur veranderende bloemen Onderzoek onthult kwantitatieve en hoge-resolutie drukfuncties van drukgevoelig materiaal
Onderzoek onthult kwantitatieve en hoge-resolutie drukfuncties van drukgevoelig materiaal
 Onderzoekers geven geïntegreerde dataset vrij van hydrologische en thermische vervorming in de technische corridor van Qinghai-Tibet
Onderzoekers geven geïntegreerde dataset vrij van hydrologische en thermische vervorming in de technische corridor van Qinghai-Tibet De mist opheffen over het logge luchtvervuilingsprobleem van China
De mist opheffen over het logge luchtvervuilingsprobleem van China Door rook en vuur, NASA zoekt naar antwoorden
Door rook en vuur, NASA zoekt naar antwoorden Geen plek zoals thuis:nieuwe theorie over hoe zalm en zeeschildpadden hun geboorteplaats vinden
Geen plek zoals thuis:nieuwe theorie over hoe zalm en zeeschildpadden hun geboorteplaats vinden  Inzicht in de veerkracht van barrière-eilanden en kustduinen na stormen
Inzicht in de veerkracht van barrière-eilanden en kustduinen na stormen
Hoofdlijnen
- Hoe Tiny Robots je gezondheid kunnen verbeteren vanuit het lichaam
- Wetenschappelijke naam voor een geslachtscel?
- Verenvervanging of ouderlijke zorg? Trekvogels laten hun nakomelingen in de steek om te vervellen
- Deze boom is het oudste levende organisme van Europa - een soort van,
- Wat volgt glycolyse als zuurstof aanwezig is?
- Beter of anders? Hoe merkdifferentiatie de beloning en winst beïnvloedt
- Hoe een moleculaire schakelaar de groei van plantenorganen vormgeeft
- Een dierlijk celmodel maken met recyclebaar materiaal
- Onderzoek toont aan dat pesticiden generaties bijen kunnen beïnvloeden. Dit is wat je doet
- De hartslag kleuren
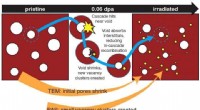
- Niet-destructieve positronenstralen sondeschade, ondersteuning van vooruitgang op het gebied van veiligheid in stralingsomgevingen
- Kunstmatige receptor maakt onderscheid tussen mannelijke en vrouwelijke hormonen

- Power-to-gas-installatie met hoog rendement

- Een biosensor detecteert binnen een uur vervalsing van paard in rundvlees

 Computermodellen suggereren dat de moderne platentektoniek het gevolg is van klodders die zijn achtergelaten door kosmische botsingen
Computermodellen suggereren dat de moderne platentektoniek het gevolg is van klodders die zijn achtergelaten door kosmische botsingen  Wat gebeurt er als je natriumhydroxideoplossing toevoegt aan wat zoutzuur in een bekerglas?
Wat gebeurt er als je natriumhydroxideoplossing toevoegt aan wat zoutzuur in een bekerglas?  Nanofotonica verbeterde dekglaasje voor fasebeeldvorming in de biologie
Nanofotonica verbeterde dekglaasje voor fasebeeldvorming in de biologie Neurale netto-activeringen zijn uitgelijnd met gamma-bandactiviteit van de menselijke visuele cortex
Neurale netto-activeringen zijn uitgelijnd met gamma-bandactiviteit van de menselijke visuele cortex Waarom is het Pentagon geïnteresseerd in UFO's?
Waarom is het Pentagon geïnteresseerd in UFO's? Nanogestructureerde dunne films die licht onder grote hoeken kunnen buigen, kunnen een vervanging zijn voor omvangrijke optische componenten van glas
Nanogestructureerde dunne films die licht onder grote hoeken kunnen buigen, kunnen een vervanging zijn voor omvangrijke optische componenten van glas Kan deskundig redeneren worden aangeleerd?
Kan deskundig redeneren worden aangeleerd?  Waarom krult je haar in de zomer? Een scheikundige legt de wetenschap achter structuur uit
Waarom krult je haar in de zomer? Een scheikundige legt de wetenschap achter structuur uit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

