
Wetenschap
Wie is sterker intermoleculaire of waterstofbrug?
Intermoleculaire krachten zijn de krachten die moleculen bij elkaar houden in een verbinding. Ze zijn zwakker dan chemische bindingen, die atomen in een molecuul bij elkaar houden. Waterstofbindingen zijn een soort intermoleculaire kracht die optreedt wanneer een waterstofatoom is gebonden aan een zeer elektronegatief atoom, zoals fluor, zuurstof of stikstof. Het elektronegatieve atoom trekt de elektronen weg van het waterstofatoom, waardoor een gedeeltelijke positieve lading op het waterstofatoom ontstaat. Deze gedeeltelijk positieve lading kan vervolgens de gedeeltelijk negatieve lading op een ander elektronegatief atoom aantrekken, waardoor een waterstofbrug ontstaat.
Waterstofbruggen zijn sterker dan andere intermoleculaire krachten omdat ze elektrostatisch van aard zijn. Elektrostatische krachten zijn sterker dan van der Waals-krachten, het andere type intermoleculaire kracht. Van der Waalskrachten worden veroorzaakt door de tijdelijke fluctuaties in de elektronenwolken van moleculen.
De sterkte van een waterstofbrug hangt af van de elektronegativiteit van de betrokken atomen en de afstand tussen de atomen. Hoe elektronegatiever de atomen, hoe sterker de waterstofbrug. Hoe korter de afstand tussen de atomen, hoe sterker de waterstofbrug.
 Ultrasnelle en ultragevoelige waterstofsensor
Ultrasnelle en ultragevoelige waterstofsensor Vloeistof-vloeistofovergangen kristalliseren nieuwe ideeën voor moleculaire vloeistoffen
Vloeistof-vloeistofovergangen kristalliseren nieuwe ideeën voor moleculaire vloeistoffen Hoe cellen hun afvalverwerkingssystemen hergebruiken om ontstekingen te bevorderen
Hoe cellen hun afvalverwerkingssystemen hergebruiken om ontstekingen te bevorderen Voorbeelden van Colligative Property
Voorbeelden van Colligative Property Microscoop voor mobiele telefoons detecteert de stille moordenaar van honingbijen
Microscoop voor mobiele telefoons detecteert de stille moordenaar van honingbijen
Hoofdlijnen
- Journal beschrijft hoe de opwarming van de aarde de visserij in de wereld zal beïnvloeden
- Internationaal onderzoek levert een uitgebreide levensboom op voor bloeiende planten
- Heeft u een interne dialoog? Niet iedereen doet dat
- Hoe groot is de kans dat Engelse leerlingen de middelbare school voltooien? Uit onderzoek blijkt dat dit afhangt van ras, geslacht en inkomen
- Hoe het genoom is verpakt in chromosomen die getrouw kunnen worden verplaatst tijdens celdeling
- Wat is het laatste nieuws over de darmflora? Concordia-studenten microbiologie publiceren hun bevindingen
- Wat gebeurt er met een Zygote na de bevruchting?
- Lichtgroene planten besparen stikstof zonder in te boeten aan fotosynthetische efficiëntie
- Recombinante DNA-technologie voor vaccinontwikkeling
- Wetenschappers controleren de elektrische kenmerken van optische geheugenapparaten

- Een zeer gevoelige nieuwe bloedtest kan zeldzame kankereiwitten detecteren
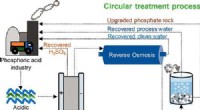
- Wetenschappers ontwikkelen een methode om gevaarlijk zuur industrieel afvalwater om te zetten in waardevolle hulpbronnen
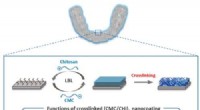
- Tandhouders en aligners helpen om bacteriën te bestrijden
- Nieuw, gladde toiletcoating zorgt voor schoner doorspoelen, bespaart water

 Een getal met een percentage vermenigvuldigen
Een getal met een percentage vermenigvuldigen Rookseizoenen zijn niet nieuw, maar onze inspanningen om bosbranden te bestrijden zijn, en zou moeten veranderen
Rookseizoenen zijn niet nieuw, maar onze inspanningen om bosbranden te bestrijden zijn, en zou moeten veranderen Tientallen nieuw ontdekte zwaartekrachtlenzen kunnen oude sterrenstelsels en de aard van donkere materie onthullen
Tientallen nieuw ontdekte zwaartekrachtlenzen kunnen oude sterrenstelsels en de aard van donkere materie onthullen Stenen werktuigen laten zien hoe eilandhoppende mensen de kost verdienden
Stenen werktuigen laten zien hoe eilandhoppende mensen de kost verdienden  Hoe vaak sturen intra-Europese migranten geld naar huis?
Hoe vaak sturen intra-Europese migranten geld naar huis?  DNAzymes zouden beter kunnen presteren dan eiwitenzymen voor genetische manipulatie
DNAzymes zouden beter kunnen presteren dan eiwitenzymen voor genetische manipulatie Hoe Polarity
Hoe Polarity Hoe zonering de uitstoot van broeikasgassen beïnvloedt
Hoe zonering de uitstoot van broeikasgassen beïnvloedt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

