
Wetenschap
Waarom is gas gemakkelijker te comprimeren dan een vloeistof of vaste stof?
Hier is een meer gedetailleerde uitleg:
* Gas: De moleculen in een gas zijn voortdurend in beweging en botsen met elkaar en de wanden van hun container. Wanneer een gas wordt gecomprimeerd, hebben de moleculen minder ruimte om te bewegen en botsen ze vaker met elkaar. Hierdoor neemt de druk van het gas toe.
* Vloeistof: De moleculen in een vloeistof zijn ook voortdurend in beweging, maar ze staan dichter bij elkaar dan de moleculen in een gas. Hierdoor hebben ze minder bewegingsruimte en komen ze vaker met elkaar in botsing. De moleculen in een vloeistof worden echter ook door intermoleculaire krachten tot elkaar aangetrokken. Deze krachten helpen de moleculen bij elkaar te houden en maken het moeilijker om de vloeistof samen te drukken.
* Vast: De moleculen in een vaste stof bevinden zich heel dicht bij elkaar en worden op hun plaats gehouden door sterke intermoleculaire krachten. Dit maakt het erg moeilijk om een vaste stof te comprimeren.
De samendrukbaarheid van een stof is een maatstaf voor hoe gemakkelijk deze kan worden gecomprimeerd. De samendrukbaarheid van een gas is veel hoger dan de samendrukbaarheid van een vloeistof of vaste stof. Dit betekent dat het veel gemakkelijker is om een gas te comprimeren dan een vloeistof of vaste stof.
 Hoe beïnvloedt de toevoeging van opgeloste stoffen het waterpotentieel?
Hoe beïnvloedt de toevoeging van opgeloste stoffen het waterpotentieel?  Goedkoop, afdrukbaar 3D-apparaat ontworpen voor het analyseren van chemicaliën van smartphones
Goedkoop, afdrukbaar 3D-apparaat ontworpen voor het analyseren van chemicaliën van smartphones Synthese van nieuwe rode fosforen met een slim materiaal als gastheermateriaal
Synthese van nieuwe rode fosforen met een slim materiaal als gastheermateriaal Eerste luminescent moleculair systeem met een lagere kritische oplossingstemperatuur
Eerste luminescent moleculair systeem met een lagere kritische oplossingstemperatuur Wat zijn de eigenschappen van vloeibaar?
Wat zijn de eigenschappen van vloeibaar?
 Een schijnbaar symbolische actie veranderde het debat over klimaatverandering
Een schijnbaar symbolische actie veranderde het debat over klimaatverandering Nieuwe wiskundige methode laat zien hoe klimaatverandering leidde tot de val van de oude beschaving
Nieuwe wiskundige methode laat zien hoe klimaatverandering leidde tot de val van de oude beschaving  Kunstmatige intelligentie helpt experts ijsbergen te voorspellen
Kunstmatige intelligentie helpt experts ijsbergen te voorspellen Blijkt dat de hartslag van de aarde elke 27,5 miljoen jaar klopt,
Blijkt dat de hartslag van de aarde elke 27,5 miljoen jaar klopt,  Braziliaans Amazonegebied ziet slechtste juni in 13 jaar voor bosbranden
Braziliaans Amazonegebied ziet slechtste juni in 13 jaar voor bosbranden
Hoofdlijnen
- Welke van de volgende DNA-strengen is een complementaire streng voor C-C-A-T-C-G A. G-G-T-A-G-C C. A-A-C-G-A-T B. G-G-A-T-G-C D. T-T-G-C-T-A?
- Rudolph, waarom is je neus zo helder? Wetenschappers van Johns Hopkins hebben een idee
- Kunnen heterotrofen hun eigen voedsel maken?
- Je bent niet wat je eet
- Een nieuwe studie laat zien hoe invasieve soorten veranderen tijdens biologische invasie
- Vergroening van citrusvruchten behandelen met koper:effecten op bomen, bodems
- Nieuwe techniek maakt succesvolle kweek van stamcellen op het oppervlak van ionische vloeistoffen mogelijk
- Wat is het ultieme eindresultaat van glycolyse?
- Pythons zijn echte verstikkende artiesten:grootte alleen verklaart niet hoe ze zulke grote prooien kunnen eten
- Archaea-enzym dat membraanlipiden produceert, is spectaculair promiscue
- Elektrische kabel triggers lichtgewicht, ontdekking van brandwerende bekleding

- Onderzoekers ontwikkelen dubbellaagse verf die warmte reflecteert

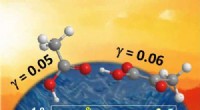
- Carbonzuren gedragen zich als superzuren op het wateroppervlak
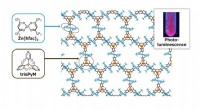
- Een nieuw recept voor luchtstabiel en hoogkristallijn radicaal-gebaseerd coördinatiepolymeer
 Interdisciplinaire samenwerking levert de moeilijkste, dunste coatings tot nu toe ontdekt
Interdisciplinaire samenwerking levert de moeilijkste, dunste coatings tot nu toe ontdekt Een onderzoeksteam ontwikkelt een methode om meer plastic te recyclen
Een onderzoeksteam ontwikkelt een methode om meer plastic te recyclen  Wat als er geen sterren waren?
Wat als er geen sterren waren?  Weather Service heeft op het laatste moment besloten de sneeuwvoorspelling niet te verlagen
Weather Service heeft op het laatste moment besloten de sneeuwvoorspelling niet te verlagen 3d printen, biologieonderzoek maakt de reis terug naar de aarde aan boord van SpaceXs Dragon
3d printen, biologieonderzoek maakt de reis terug naar de aarde aan boord van SpaceXs Dragon Het antwoord vinden op een eeuwenoude vraag:hoe ontstaan sneeuwvlokken?
Het antwoord vinden op een eeuwenoude vraag:hoe ontstaan sneeuwvlokken? Is het waar dat licht met dezelfde snelheid door alle transparante media reist?
Is het waar dat licht met dezelfde snelheid door alle transparante media reist?  Helpen klantloyaliteitsprogramma's verkopers echt om geld te verdienen?
Helpen klantloyaliteitsprogramma's verkopers echt om geld te verdienen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

