
Wetenschap
Het antwoord vinden op een eeuwenoude vraag:hoe ontstaan sneeuwvlokken?
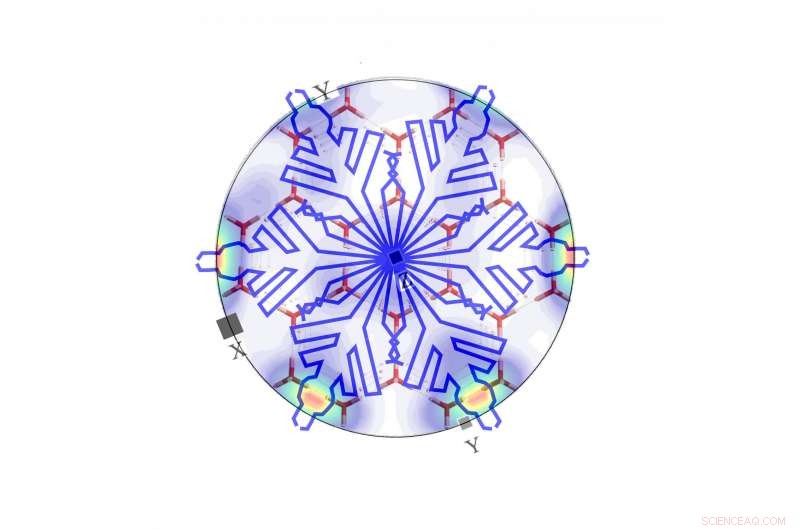
Deze afbeelding weerspiegelt drie schalen:de macroscopische sneeuwvlok (blauwe lijnen), de moleculaire structuur (rode buismodel), en de elektronenverstrooiingsdiffractie (dichtheidsplot). Krediet:Tufts University
Meer dan 400 jaar geleden, de beroemde wiskundige en wetenschapper Johannes Kepler speculeerde over de creatie van een van de meest engelachtige en unieke vormen van de natuur:de zeshoekige sneeuwvlok. Hoewel atomen pas meer dan twee eeuwen later zouden worden ontdekt, Kepler dacht openlijk na over de microscopisch kleine bouwstenen die leiden tot de zeshoekige vorming van het ijskristal, inclusief de talloze factoren achter dit terugkerende fenomeen.
Nutsvoorzieningen, onderzoek onder leiding van een scheikundige van de Tufts University heeft de vragen van Kepler beantwoord door nieuw licht op dit proces te werpen door een elektronenterugverstrooiing te combineren met een groot enkelkristalijsmodel. In een studie gepubliceerd in de Proceedings van de National Academy of Sciences , wetenschappers ontdekten dat de platte zijden van een ijskristal worden gevormd door een zeshoek die groter is en bestaat uit een centraal watermolecuul omringd door zes andere in dezelfde laag.
Mary Jane Shultz, doctoraat, een professor scheikunde aan de School of Arts and Sciences van Tufts University en eerste auteur van de studie, zei dat de zeshoek in de vorm van een stoel drie moleculen in één laag heeft en drie iets lager in wat een dubbellaagse structuur wordt genoemd. De zes platte zijden van een sneeuwvlok groeien uit een zeshoek die in één laag is gevormd. Deze grotere zeshoek is 30 graden gedraaid ten opzichte van de stoelvormige zeshoek.
"Sneeuwvlokken groeien uit waterdamp. Gezichten die de meeste warmte afgeven (per oppervlakte-eenheid) verdampen, " zei Shultz. "Het gezicht met de minste warmteafgifte is het zeshoekige gezicht; het volgende is het platte vlak van de grotere zeshoek. De platte kant van de stoelvormige zeshoek geeft de meeste warmte af per gebied, die zichzelf verdampt. Dus, het zeshoekige prisma van de sneeuwvlok heeft platte zijden die overeenkomen met de grotere zeshoek."

Krediet:Pixabay
De onderzoeksresultaten ontkrachten eerdere aannames dat sneeuwvlokken groeien vanaf de platte zijden van de stoelvormige zeshoek, zei Shultz.
Om te bepalen hoe de vorming plaatsvindt, onderzoekers bouwden een model dat de warmte die vrijkomt wanneer moleculen in het vaste rooster worden opgenomen, in evenwicht houdt met de kans op succesvolle hechting. Door technieken op macroscopisch en moleculair niveau te combineren, kon het team hetzelfde oppervlak op verschillende schalen onderzoeken.
De macroscopische sonde wordt al tientallen jaren gebruikt om ijs te onderzoeken. Deze techniek produceert de prachtige visuele beelden van de macroscopische zeshoekige vorm. De sonde op moleculair niveau is recenter. Hoewel een röntgenfoto vaak wordt gebruikt om het moleculaire niveau aan te tonen, Shultz en haar team kozen ervoor om de elektronen-backscatter-diffractietechniek te gebruiken, die oriëntatiedichtheidsgrafieken produceert die illustratiever en visueel aantrekkelijker zijn.
"Door de oriëntatie van het monster zorgvuldig te volgen, konden we de twee afbeeldingen koppelen om de verbinding tot stand te brengen, " ze zei.
Het onderzoek bevestigde dat sneeuwvlokpunten in lijn liggen met de kristallografische a-assen die worden weergegeven als hotspots in de elektronenterugverstrooiingsgegevens. De betekenis is dat de platte kant van een sneeuwvlok uit een dubbellaagse structuur bestaat. Het basale gezicht is een stoelvormige zeshoek; de up-down wijziging vormt een dubbellaag. De platte kant is een bootvormige zeshoek bestaande uit paren watermoleculen die paren in de onderste helft van de dubbellaag overbruggen. Flexibiliteit en mobiliteit van een paar zal naar verwachting resulteren in een unieke reactiviteit van dit gezicht, inclusief potentieel katalyserende omzetting van gassen zoals CO2 en stikstofoxiden in de atmosfeer. Shultz zei dat het team deze reactiviteit nu onderzoekt.
 Storm Humberto wordt sterker, maar trekt weg van Bahama's en VS
Storm Humberto wordt sterker, maar trekt weg van Bahama's en VS Bacteriën in omgevingen met een ijzertekort verwerken selectief koolstofbronnen
Bacteriën in omgevingen met een ijzertekort verwerken selectief koolstofbronnen Overstromingen in Paraguay dwingen duizenden huizen te evacueren
Overstromingen in Paraguay dwingen duizenden huizen te evacueren Waarnemingen bevestigen dat aerosolen gevormd uit door planten uitgestoten stoffen wolken helderder kunnen maken
Waarnemingen bevestigen dat aerosolen gevormd uit door planten uitgestoten stoffen wolken helderder kunnen maken Wat is de toekomst van bioplastics?
Wat is de toekomst van bioplastics?
Hoofdlijnen
- Wetenschappers ontwikkelen nieuwe aanpak om belangrijke onontdekte functies van eiwitten te identificeren
- Ontdekkingen van donkere materie kunnen licht werpen op nieuwe behandelingen voor ziekten
- Wat is een andere naam voor somatische stamcellen en wat doen ze?
- 10 slechtste aanpassingen in het dierenrijk
- Hoe evolueert de mens?
- Wat is het doel van mitose?
- Een betere manier om pesticiden van appels te wassen
- Nieuwe oude dolfijnsoort Urkudelphis chawpipacha ontdekt in Ecuador
- Law of Segregation (Mendel): definitie, toelichting en voorbeelden
- Hoe bouw je een sterk en stabiel structuurproject voor school

- Nieuw experiment meet neutronenhuid in calcium

- NIST verbetert het Johnson-noise thermometriesysteem

- GitHub-archiefopslag begraven tot de laatste 1, 000 jaar

- Common-path off-axis digitale holografie:op weg naar een zeer stabiele productie van optische instrumenten
 Kleine magnetische schijfjes kunnen kankercellen doden:studie
Kleine magnetische schijfjes kunnen kankercellen doden:studie Kleine tools:individuele waterdruppels besturen als biochemische reactoren
Kleine tools:individuele waterdruppels besturen als biochemische reactoren Bio-geïnspireerde koolstofanoden maken hoge prestaties mogelijk in lithium-ionbatterijen
Bio-geïnspireerde koolstofanoden maken hoge prestaties mogelijk in lithium-ionbatterijen Halloween is een belangrijke manier om over de dood na te denken
Halloween is een belangrijke manier om over de dood na te denken Hoe te bepalen of de binding tussen twee atomen polair is?
Hoe te bepalen of de binding tussen twee atomen polair is?
Atomen vormen twee soorten obligaties: ionisch en covalent. Ionische bindingen, die voorkomen tussen elementen in Groep 1 van het periodiek systeem (metalen) en die in Groep 17 (halogenen),
 Datacenters in China gaan meer stroom verbruiken dan Australië:rapport
Datacenters in China gaan meer stroom verbruiken dan Australië:rapport Wetenschappers bestuderen lava voor aanwijzingen over hoe vulkaan zich zal gedragen
Wetenschappers bestuderen lava voor aanwijzingen over hoe vulkaan zich zal gedragen Caps niet de boosdoener in chiraliteit van nanobuisjes
Caps niet de boosdoener in chiraliteit van nanobuisjes
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

