
Wetenschap
Hoe verhouden ionische verbindingen en de empirische formule zich tot elkaar?
Neem bijvoorbeeld de ionische verbinding natriumchloride (NaCl). De empirische formule van natriumchloride is NaCl, wat betekent dat er één natriumion is voor elk chloride-ion in de verbinding. Dit is ook de verhouding tussen positief en negatief geladen ionen in natriumchloride.
Op dezelfde manier is de empirische formule van calciumfluoride (CaF2) CaF2, wat betekent dat er één calciumion is voor elke twee fluoride-ionen in de verbinding. Dit is ook de verhouding tussen positief en negatief geladen ionen in calciumfluoride.
De empirische formule van een ionische verbinding kan worden gebruikt om de chemische formule van de verbinding te bepalen. De chemische formule van een ionische verbinding geeft het werkelijke aantal atomen van elk element in de verbinding.
Om de chemische formule van een ionische verbinding te bepalen, moeten we eerst de empirische formule kennen. Zodra we de empirische formule kennen, kunnen we de subscripts in de empirische formule vermenigvuldigen met de juiste gehele getallen om de chemische formule te krijgen.
De empirische formule van natriumchloride is bijvoorbeeld NaCl. Om de chemische formule te krijgen, moeten we de subscripts in de empirische formule met 2 vermenigvuldigen. Dit geeft ons de chemische formule NaCl2, de molecuulformule van natriumchloride.
Op dezelfde manier is de empirische formule van calciumfluoride CaF2. Om de chemische formule te krijgen, moeten we de subscripts in de empirische formule met 2 vermenigvuldigen. Dit geeft ons de chemische formule CaF4, de molecuulformule van calciumfluoride.
 Wat is een ionische verbinding?
Wat is een ionische verbinding?  Ingenieurs maken injecteerbare weefsels werkelijkheid
Ingenieurs maken injecteerbare weefsels werkelijkheid 30,4 gram X2O3-gas zorgt voor een druk van 2 atm bij 273 C in een container van 8,96 liter. Dus hoeveel g.mol is de molaire massa X-atoom (O:16)?
30,4 gram X2O3-gas zorgt voor een druk van 2 atm bij 273 C in een container van 8,96 liter. Dus hoeveel g.mol is de molaire massa X-atoom (O:16)?  Nieuwe verbinding kan fotodynamische therapie voor kanker verbeteren
Nieuwe verbinding kan fotodynamische therapie voor kanker verbeteren Baanbrekende kwantumchemietechniek voor computationeel ontwerp en optimalisatie van organische fotofunctionele materialen
Baanbrekende kwantumchemietechniek voor computationeel ontwerp en optimalisatie van organische fotofunctionele materialen
 Naarmate meer van de Pacific Northwest brandt, ernstige branden veranderen bosecologie
Naarmate meer van de Pacific Northwest brandt, ernstige branden veranderen bosecologie Onderzoek toont aan dat bodembedekkers en vaste planten niet noodzakelijkerwijs de koolstofopslag in de bodem vergroten
Onderzoek toont aan dat bodembedekkers en vaste planten niet noodzakelijkerwijs de koolstofopslag in de bodem vergroten Zeldzame gletsjeronderzoeksnotitieboekjes nu digitaal verkrijgbaar
Zeldzame gletsjeronderzoeksnotitieboekjes nu digitaal verkrijgbaar Vlieg meer, minder vervuilen - het grote luchtvaartraadsel
Vlieg meer, minder vervuilen - het grote luchtvaartraadsel NASA ziet orkaan Helene ontkoppeld door windschering
NASA ziet orkaan Helene ontkoppeld door windschering
Hoofdlijnen
- Je bent niet wat je eet
- 'Touwtrekken' tussen cellen:wat gebeurt er als cruciale verbindingen ontbreken?
- Hoe je geur te verbergen voor honden
- Plantwetenschappelijk onderzoek maakt de weg vrij voor een beter begrip van de werking van het immuunsysteem van planten
- Verschillen tussen een neuron en een neuroglia
- Forensische wetenschapsprojecten voor middelbare scholieren
- AI gebruiken om genomische afwegingen tussen soorten mutaties te identificeren
- Hoe cellen in vorm blijven
- Celsignalen die wondgenezing in gang zetten zijn verrassend complex
- Natuurlijke stoffen zijn veelbelovend tegen het coronavirus

- Gekleurd borduurgaren op aanvraag bespaart tijd, geld en het milieu

- Hoogwaardige nitridehalfgeleider voor milieuvriendelijke fotovoltaïsche energie
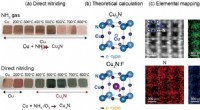
- Onderzoek onthult de chemische onderbouwing van hoe goedaardig water kan veranderen in hard waterstofperoxide

- Moleculaire bibliotheken voor organische lichtemitterende diodes
 De gletsjers gaan
De gletsjers gaan Video:Gaias stellaire beweging voor de komende 1,6 miljoen jaar
Video:Gaias stellaire beweging voor de komende 1,6 miljoen jaar 22 oude amforen gevonden voor de Albanese kust
22 oude amforen gevonden voor de Albanese kust Studie van USPS-statistieken suggereert dat werken bij hoge temperaturen leidt tot meer intimidatie en discriminatie
Studie van USPS-statistieken suggereert dat werken bij hoge temperaturen leidt tot meer intimidatie en discriminatie  Verzwakte Eta doordrenkt Honduras; zou de Golf van Mexico kunnen bereiken
Verzwakte Eta doordrenkt Honduras; zou de Golf van Mexico kunnen bereiken Zwak gebonden zout is een belangrijk ingrediënt voor zeer zuivere Li@C60-film
Zwak gebonden zout is een belangrijk ingrediënt voor zeer zuivere Li@C60-film 2, 000 jaar stormen in het Caribisch gebied
2, 000 jaar stormen in het Caribisch gebied Hoe raciale vooroordelen de internettoegang voor gekleurde mensen kunnen beperken
Hoe raciale vooroordelen de internettoegang voor gekleurde mensen kunnen beperken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

