
Wetenschap
Wat is de beste manier om een zuur te neutraliseren?
Als u bijvoorbeeld een sterk zuur zoals zoutzuur (HCl) heeft, heeft u een sterke base zoals natriumhydroxide (NaOH) nodig om dit te neutraliseren. De reactie tussen HCl en NaOH kan als volgt worden weergegeven:
```
HCl + NaOH → NaCl + H2O
```
Bij deze reactie reageren de HCl en NaOH onder vorming van natriumchloride (NaCl) en water (H2O). De NaCl is een zout en de H2O is een neutrale stof.
Als u een zwak zuur zoals azijnzuur (CH3COOH) heeft, kunt u een zwakkere base zoals natriumbicarbonaat (NaHCO3) gebruiken om het te neutraliseren. De reactie tussen CH3COOH en NaHCO3 kan als volgt worden weergegeven:
```
CH3COOH + NaHCO3 → CH3COONa + H2O + CO2
```
Bij deze reactie reageren de CH3COOH en NaHCO3 onder vorming van natriumacetaat (CH3COONa), water (H2O) en kooldioxide (CO2). De CH3COONa is een zout, de H2O is een neutrale stof en de CO2 is een gas.
De hoeveelheid base die nodig is om een zuur te neutraliseren, kan worden berekend met behulp van de volgende formule:
```
mol base =mol zuur × (valentie van zuur / valentie van base)
```
Als je bijvoorbeeld 1 mol HCl (valentie 1) hebt en je wilt deze neutraliseren met NaOH (valentie 1), dan heb je 1 mol NaOH nodig. Als je 1 mol CH3COOH (valentie 1) hebt en je wilt deze neutraliseren met NaHCO3 (valentie 2), dan heb je 2 mol NaHCO3 nodig.
Het is belangrijk op te merken dat u bij het neutraliseren van een zuur de base altijd langzaam aan het zuur moet toevoegen, onder voortdurend roeren. Dit zal helpen voorkomen dat de reactie te krachtig wordt en spatten veroorzaakt.
 Wat is butaanthiol?
Wat is butaanthiol?  Wat is er anders aan de oplossing als je een homogeen mengsel en een oplossing vergelijkt?
Wat is er anders aan de oplossing als je een homogeen mengsel en een oplossing vergelijkt?  Hoe rangschik je stoffen in oplopende volgorde als je weet wat hun dichtheid is en welke stof verschillende vloeistoffen laat zinken of drijven?
Hoe rangschik je stoffen in oplopende volgorde als je weet wat hun dichtheid is en welke stof verschillende vloeistoffen laat zinken of drijven?  Wat is een zydeco-wrijfbord?
Wat is een zydeco-wrijfbord?  Is het delen van elektronen in polaire covalente bindingen gelijk?
Is het delen van elektronen in polaire covalente bindingen gelijk?
 Klimaatprojecties tonen een warmere toekomst voor het noordwesten van de Stille Oceaan
Klimaatprojecties tonen een warmere toekomst voor het noordwesten van de Stille Oceaan 2023–24 El Niño zal in sommige gebieden waarschijnlijk recordbrekende gemiddelde temperaturen veroorzaken
2023–24 El Niño zal in sommige gebieden waarschijnlijk recordbrekende gemiddelde temperaturen veroorzaken  Nieuwe regels en nieuwe technologie geven Californische boeren en managers een betere kijk op grondwatervoorraden
Nieuwe regels en nieuwe technologie geven Californische boeren en managers een betere kijk op grondwatervoorraden NASA-NOAA's Suomi NPP-satelliet vindt een zwakkere tropische storm Leepi
NASA-NOAA's Suomi NPP-satelliet vindt een zwakkere tropische storm Leepi Naarmate het overstromingsrisico in de VS toeneemt, het is tijd om de grenzen van dijken te herkennen
Naarmate het overstromingsrisico in de VS toeneemt, het is tijd om de grenzen van dijken te herkennen
Hoofdlijnen
- Twee Caribische vogelvangbomen vernoemd naar twee vrouwen met over het hoofd gezien botanische werken
- Genomics-onderzoek identificeert een unieke set eiwitten die het gehoor bij zebravissen herstellen
- Hoe de anemoonvis zijn strepen verdiende:evolutie van kleurpatronen bij koraalrifvissen
- Epigenetische erfenis:een 'zilveren kogel' tegen klimaatverandering?
- Onderzoekers ontdekken hoe cellen de fysieke toestand van embryonale weefsels controleren
- Wat is de taak van mitochondriën in een dierlijke cel?
- Hoe vermijdt planten-DNA de verwoestingen van UV-straling?
- Coyotes in New York City hoeven niet afhankelijk te zijn van menselijke voeding
- Onderzoekers ontdekken slecht begrepen bacteriële lijnen in de monden van dolfijnen
- Nieuwe strategie voor medicijnontwerp:koperatomen dichterbij houden om bacteriën weg te houden
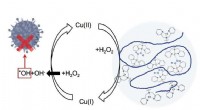
- Betaalbare loodsensor voor thuis, stadswaterleidingen

- Video:Waarom je geen verse olijven kunt kopen

- Nieuwe techniek maakt snelle screening op nieuwe typen zonnecellen mogelijk

- Organische polymere scintillatoren prikkelen de röntgengemeenschap

 Waarin verschilt kaliumhydroxide van verdund salpeterzuur?
Waarin verschilt kaliumhydroxide van verdund salpeterzuur?  Centra voor voor- en vroegschoolse educatie kunnen de betrokkenheid van ouders thuis vergroten
Centra voor voor- en vroegschoolse educatie kunnen de betrokkenheid van ouders thuis vergroten Hoe genderidentiteitsstoornis werkt
Hoe genderidentiteitsstoornis werkt  De chemische evolutie van DNA en RNA op de vroege aarde
De chemische evolutie van DNA en RNA op de vroege aarde Astronomen helpen oorlog te voeren tegen kanker
Astronomen helpen oorlog te voeren tegen kanker Waarom het verhogen van de productie van schaliegas de uitstoot van broeikasgassen niet zal verminderen
Waarom het verhogen van de productie van schaliegas de uitstoot van broeikasgassen niet zal verminderen  Analyse:Moet je de nieuwe iPhone 5 kopen?
Analyse:Moet je de nieuwe iPhone 5 kopen?  Duitsland verliest 1 van zijn 5 gletsjers door de hete zomer
Duitsland verliest 1 van zijn 5 gletsjers door de hete zomer
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

