
Wetenschap
Welke eigenschappen van een stof bepalen hoe die zal reageren in combinatie met andere stoffen?
1. Chemische samenstelling:
- De chemische samenstelling van een stof, inclusief de aanwezige elementen en hun rangschikking, beïnvloedt de reactiviteit ervan. De aanwezigheid van bepaalde functionele groepen of atomen, zoals dubbele bindingen, elektronegatieve atomen of reactieve metalen, kan er bijvoorbeeld voor zorgen dat een stof gevoeliger is voor reacties met andere.
2. Chemische structuur:
- De moleculaire structuur van een stof beïnvloedt de reactiviteit ervan. Factoren zoals bindingslengte, bindingshoeken en moleculaire geometrie beïnvloeden de toegankelijkheid en reactiviteit van verschillende delen van het molecuul. Een lineaire structuur kan bijvoorbeeld gemakkelijker toegang tot bepaalde atomen mogelijk maken vergeleken met een cyclische structuur.
3. Polariteit:
- Polariteit verwijst naar de verdeling van elektrische lading binnen een molecuul. Polaire moleculen hebben een gedeeltelijk positieve en gedeeltelijk negatieve lading vanwege verschillen in elektronegativiteit. Polariteit beïnvloedt de interacties en reactiviteit van stoffen met andere polaire of niet-polaire moleculen.
4. Functionele groepen:
- Functionele groepen zijn specifieke groepen atomen binnen een molecuul die karakteristieke chemische eigenschappen verlenen. De aanwezigheid van functionele groepen, zoals hydroxyl- (-OH), carboxyl- (-COOH) of amino- (-NH2) groepen, kan bepalend zijn voor het soort reacties dat een stof ondergaat.
5. Oxidatietoestand:
- De oxidatietoestand van een stof beschrijft de mate van oxidatie of reductie van zijn atomen. Stoffen met verschillende oxidatietoestanden kunnen verschillende reactiviteit vertonen. Een element in een hogere oxidatietoestand kan bijvoorbeeld reactiever zijn omdat het gemakkelijker reductie kan ondergaan.
6. Waterstofbinding:
- Waterstofbinding is een dipool-dipoolinteractie tussen een waterstofatoom dat covalent gebonden is aan een elektronegatief atoom (zoals N, O of F) en een ander elektronegatief atoom. De aanwezigheid van waterstofbruggen beïnvloedt de oplosbaarheid en reactiviteit van een stof, vooral met polaire oplosmiddelen of stoffen die waterstofbruggen kunnen vormen.
7. pH:
- De pH van een stof, die de zuurgraad of basiciteit ervan meet, beïnvloedt de reactiviteit ervan. Veel chemische reacties zijn gevoelig voor de pH van de omgeving. Enzymen, die biologische katalysatoren zijn, hebben bijvoorbeeld een optimaal pH-bereik waarbij ze maximale activiteit vertonen.
8. Temperatuur:
- Temperatuur beïnvloedt de kinetische energie van moleculen en de frequentie van botsingen daartussen. Hogere temperaturen verhogen doorgaans de reactiesnelheid omdat moleculen sneller bewegen en meer energie hebben om activeringsenergiebarrières te overwinnen.
9. Concentratie:
- De concentratie van een stof beïnvloedt de reactiviteit ervan. Over het algemeen leiden hogere concentraties tot een grotere kans op botsingen tussen moleculen, waardoor de reactiesnelheid toeneemt.
Het begrijpen van deze eigenschappen van een stof geeft inzicht in het chemische gedrag en de reactiviteit ervan in combinatie met andere stoffen. Door rekening te houden met deze eigenschappen kunnen scheikundigen chemische reacties voorspellen en ontwerpen, nieuwe materialen ontwikkelen en verschillende verschijnselen in de natuurlijke wereld begrijpen.
 Kunnen biologische gewasbeschermingsmiddelen gewassen beschadigen?
Kunnen biologische gewasbeschermingsmiddelen gewassen beschadigen?  Helium is essentieel voor onderzoek en medische apparatuur, maar het is niet hernieuwbaar en moeilijk te recyclen
Helium is essentieel voor onderzoek en medische apparatuur, maar het is niet hernieuwbaar en moeilijk te recyclen  Broom tegen chloorbinding Energie
Broom tegen chloorbinding Energie  Onderzoekers streven naar goedkope, efficiënte technologieën voor waterstofopwekking
Onderzoekers streven naar goedkope, efficiënte technologieën voor waterstofopwekking Wat voor soort chemische reactie vindt plaats wanneer waterstofperoxide uiteen kan vallen en water en zuurstofgas kan vormen?
Wat voor soort chemische reactie vindt plaats wanneer waterstofperoxide uiteen kan vallen en water en zuurstofgas kan vormen?
 100 jaar oude fruitcake tussen de artefacten van Kaap Adare
100 jaar oude fruitcake tussen de artefacten van Kaap Adare Onderzoekers bestuderen effecten van klimaatverandering op bodems bij militaire installaties
Onderzoekers bestuderen effecten van klimaatverandering op bodems bij militaire installaties Licht werpen op de donkere kant van vervuiling door biomassaverbranding
Licht werpen op de donkere kant van vervuiling door biomassaverbranding Welke aanpassingen hebben wolven?
Welke aanpassingen hebben wolven?  Hoe sloppenwijken veerkrachtiger kunnen worden tegen de klimaatverandering
Hoe sloppenwijken veerkrachtiger kunnen worden tegen de klimaatverandering
Hoofdlijnen
- Nieuwe studie onderzoekt hoe bacteriën immuniteit verwerven
- Hoe draken werken
- Wat is seksuele ‘nazorg’ en wat betekent dit voor toestemmingseducatie?
- Haaien evolueerden vliegtuigachtige attributen om in habitats te passen
- Geheimen van vetplanten water-wijs manieren onthuld
- Opslagkamers binnen een cel heten?
- Hoe pathogene bacteriën een kleverig adhesie-eiwit bereiden
- Hoe een 3D-model voor celbiologieprojecten te bouwen Mitochondria & Chloroplast
- Wetenschappers onderzoeken hoe olie de kleinste organismen in Antarctische wateren beïnvloedt
- pinMOS:nieuw geheugenapparaat kan optisch of elektrisch worden beschreven en uitgelezen
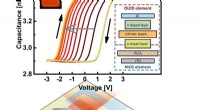
- Nieuwe supercondensors slaan elektrische lading op in textielmaterialen

- Werkende eiwitten maken goed gebruik van frustratie
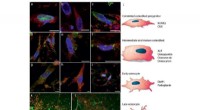
- Onderzoekers kweken het meest levensechte bot tot nu toe uit geweven cellen
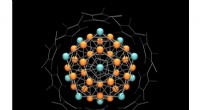
- Heterometallische koper-aluminium superatoom ontdekt
 Oerwoud dreigt nieuwe botsing EU-Polen te veroorzaken
Oerwoud dreigt nieuwe botsing EU-Polen te veroorzaken Donker toerisme is gegroeid rond de mythe van de gevangenisboom
Donker toerisme is gegroeid rond de mythe van de gevangenisboom Samen beter:wetenschappers ontdekken toepassingen van nanodeeltjes met meerdere elementen
Samen beter:wetenschappers ontdekken toepassingen van nanodeeltjes met meerdere elementen Zwaar verrijkt:een energiezuinige manier om waterstofisotopen in silicium te verrijken
Zwaar verrijkt:een energiezuinige manier om waterstofisotopen in silicium te verrijken Herontwerp dating-apps om raciale vooroordelen te verminderen, studie beveelt aan
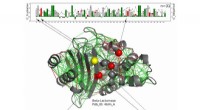
Herontwerp dating-apps om raciale vooroordelen te verminderen, studie beveelt aan Studie richt zich op LigM vanwege zijn rol bij het afbreken van aromatische verontreinigende stoffen
Studie richt zich op LigM vanwege zijn rol bij het afbreken van aromatische verontreinigende stoffen Vulkanische as legt vluchten op Spaans eiland stil
Vulkanische as legt vluchten op Spaans eiland stil Maanlandvormen duiden op geologisch recente seismische activiteit op de maan
Maanlandvormen duiden op geologisch recente seismische activiteit op de maan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

