
Wetenschap
Studie richt zich op LigM vanwege zijn rol bij het afbreken van aromatische verontreinigende stoffen
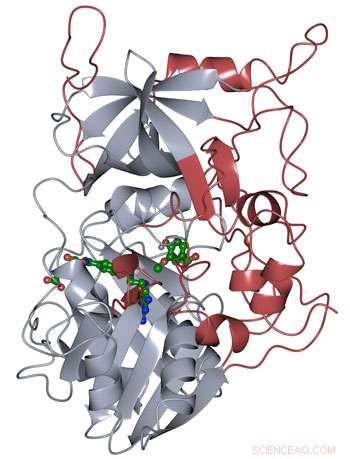
De eiwitstructuur van LigM werd bepaald met behulp van röntgenkristallografie, onthullende nieuwe structurele elementen die uniek zijn voor LigM (rood) naast een geconserveerd tetrahydrofolaat-bindend domein (grijs) dat gedurende het hele leven wordt gevonden. LigM bindt aan zijn substraten (groen) met behulp van interne bindingsholten. Krediet:Amanda Kohler/JBEI
Een eiwit dat door gewone bodembacteriën wordt gebruikt, geeft nieuwe aanwijzingen in de poging om arylverbindingen om te zetten, een veel voorkomend afvalproduct van industriële en landbouwpraktijken, tot iets van waarde.
Onderzoekers van het Lawrence Berkeley National Laboratory van het Department of Energy (Berkeley Lab) en Sandia National Laboratories van het Joint BioEnergy Institute (JBEI) hebben de eiwitstructuur van het enzym LigM opgelost, die wordt gebruikt door de bodembacterie Sphingomonas om arylverbindingen afgeleid van lignine te metaboliseren, de stijve, organisch materiaal dat planten hun structuur geeft.
Hun werk wordt vandaag gerapporteerd in de Proceedings van de National Academy of Sciences .
Bij de productie van biobrandstoffen arylverbindingen zijn een bijproduct van de afbraak van lignine. Veel van de routes die leiden tot de afbraak van lignine omvatten demethylering, wat vaak een cruciale voorloper is van eventuele aanvullende stappen bij het modificeren van van lignine afgeleide arylverbindingen.
Studie hoofdauteur Amanda Kohler, JBEI postdoctoraal onderzoeker bij Sandia, merkte op dat LigM een aantrekkelijk demethylase is voor gebruik bij aromatische omzetting omdat het een eenvoudige, enkel-enzymsysteem. LigM is ook in staat om zijn functionaliteit over een breed temperatuurbereik te behouden.
"Als we nieuwe wegen proberen te bouwen in de synthetische biologie, hoe eenvoudiger het systeem, hoe beter, ’ zei Kohler.

Postdoctoraal onderzoeker Amanda Kohler zet enzymreacties op als onderdeel van JBEI's Enzyme Optimization Group. Krediet:Marilyn Chung/Berkeley Lab
De onderzoekers ontdekten dat de helft van het LigM-enzym homoloog was aan bekende structuren met een tetrahydrofolaat-bindend domein dat zowel in eenvoudige als in complexe organismen wordt aangetroffen. De andere helft van LigM's structuur is volledig uniek, het verschaffen van een startpunt voor het bepalen waar de arylsubstraat-bindingsplaats zich bevindt. Ze kwamen er ook achter dat LigM een tyrosine-afhankelijk demethylase is.
"Het is de eerste in zijn soort die is geïdentificeerd, " zei Kohler. "Dit onderzoek biedt de broodnodige basis om te helpen bij de ontwikkeling van een op enzymen gebaseerd systeem om aromatische afvalproducten om te zetten in iets nuttigs."
Kohler zei dat ze nu werken aan de engineering van LigM, zodat het in staat is om op een breder scala aan arylsubstraten in te werken, naast het richten op specifieke arylafvalproducten.
 De houtkap moet stoppen in het grootste stroomgebied van de watervoorziening van Melbourne
De houtkap moet stoppen in het grootste stroomgebied van de watervoorziening van Melbourne vulkaan Indonesië barst uit, spuwt gloeiend hete lava
vulkaan Indonesië barst uit, spuwt gloeiend hete lava Vreemde aardbeving onthult verborgen mechanisme
Vreemde aardbeving onthult verborgen mechanisme Effecten van autoverontreinigende stoffen op het milieu
Effecten van autoverontreinigende stoffen op het milieu  Vluchtshaming zou kunnen helpen miljarden aan geld van luchtvaartmaatschappijen vrij te maken om de Amazone en andere tropische bossen te beschermen
Vluchtshaming zou kunnen helpen miljarden aan geld van luchtvaartmaatschappijen vrij te maken om de Amazone en andere tropische bossen te beschermen
Hoofdlijnen
- Hoe maak je een modelhart met materialen uit je thuis
- Pogingen om te vangen, red het bedreigde einde van de bruinvis in Mexico
- Onderzoeker onderzoekt de rol van kleine RNA's in communicatie tussen cellen
- Ja,
- Hoe koeien tevreden te houden?
- Hoe goede bacteriën je genen beheersen
- De soorten elektroforese
- Gekooide blauwe mosselen als milieudetectives
- Wetenschappers pleiten voor een wereldwijde kiembank
- Wetenschappers vinden lijm uit die wordt geactiveerd door magnetisch veld

- Kleinschalig, grote verbeteringen

- Wetenschappers maken galactische bouwstenen om de ruimte tussen sterren te bestuderen

- Onderzoekers creëren eerste draagbare technologie voor het detecteren van cyanotoxinen in water

- Doorbraak in industrieel CO2-gebruik
 Canada overweegt belasting op internetreuzen
Canada overweegt belasting op internetreuzen Dode zone in de Golf van Mexico zal naar verwachting niet snel krimpen
Dode zone in de Golf van Mexico zal naar verwachting niet snel krimpen Activiteiten van het vijfde leerjaar op Force & Motion
Activiteiten van het vijfde leerjaar op Force & Motion Een ruimtespeeltuin voor de vierde staat van materie
Een ruimtespeeltuin voor de vierde staat van materie Ingenieurs ontwikkelen 3D-geprinte metamaterialen die mechanische eigenschappen veranderen onder magnetische velden
Ingenieurs ontwikkelen 3D-geprinte metamaterialen die mechanische eigenschappen veranderen onder magnetische velden Massale uitsterving van de biodiversiteit op land en zee 250 miljoen jaar geleden niet gelijktijdig
Massale uitsterving van de biodiversiteit op land en zee 250 miljoen jaar geleden niet gelijktijdig Ontdekking kan leiden tot zelfrijdende robots
Ontdekking kan leiden tot zelfrijdende robots Nieuwe hout-metaalhybride voor lichtgewicht constructie
Nieuwe hout-metaalhybride voor lichtgewicht constructie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Norway | Spanish | Danish |

-
Wetenschap © https://nl.scienceaq.com

