
Wetenschap
Wat is de covalente binding van CO2?
De Lewis-structuur van kooldioxide laat zien dat het koolstofatoom omgeven is door vier elektronen, twee van elk zuurstofatoom. Dit voldoet aan de octetregel voor koolstof, die stelt dat koolstofatomen doorgaans acht elektronen in hun buitenste schil hebben. De twee zuurstofatomen hebben elk zes elektronen in hun buitenste schil, wat ook voldoet aan de octetregel.
De dubbele bindingen tussen de koolstof- en zuurstofatomen in kooldioxide zijn sterk en stabiel, waardoor het een relatief inert molecuul is. Dit is de reden waarom kooldioxidegas vaak wordt gebruikt als brandblusser, omdat het zuurstof kan verdringen en verbranding kan voorkomen. Kooldioxide wordt ook gebruikt bij de productie van koolzuurhoudende dranken, omdat het in water oplost en koolzuur vormt, waardoor deze dranken hun pittige smaak krijgen.
 Twee enorme stormen in twee weken, maar zijn het volledig natuurrampen?
Twee enorme stormen in twee weken, maar zijn het volledig natuurrampen? NASA-beelden onthullen sterkste gebieden van Tropical Storm Beta
NASA-beelden onthullen sterkste gebieden van Tropical Storm Beta NASA vindt een piekerige, door de wind geschoren tropische depressie 06W
NASA vindt een piekerige, door de wind geschoren tropische depressie 06W Afname van de uitstoot van koolstofdioxide door fossiele brandstoffen als gevolg van COVID-19 gedetecteerd door atmosferische waarnemingen
Afname van de uitstoot van koolstofdioxide door fossiele brandstoffen als gevolg van COVID-19 gedetecteerd door atmosferische waarnemingen NASA berekent tropische storm Harveys overstromende regenval
NASA berekent tropische storm Harveys overstromende regenval
Hoofdlijnen
- Wat zijn de zes belangrijkste elementen in levende organismen?
- Zijn er mitochondriën in een dierlijke cel?
- Welk proces voeren Ribosomes uit?
- Onderzoek onthult verschillen in DNA-vouwing tussen neuronen en andere hersencellen en koppelt deze aan celfuncties
- Kunnen mRNA-vaccins de veehouderij helpen stimuleren?
- Lang leve Nemo! Nieuw diermodel in verouderingsonderzoek?
- Kan ik een medicijn nemen om een bepaalde herinnering uit te wissen?
- Het menselijk genoomproject heeft de sequentie van basenparen in zijn geheel bepaald. Hoe heeft dit een directe invloed op ons begrip van genetische ziekten?
- Onderzoekers testen intelligentie van Afrikaanse grijze papegaai
- Hoe mosselen een krachtige onderwaterlijm maken

- Onderzoekers zetten belangrijke stap richting schoner, duurzamere productie van waterstof
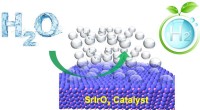
- Onderzoekers onthullen verborgen genetische regels voor hoe het leven op aarde begon

- Tandem katalytisch systeem zet koolstofdioxide efficiënt om in methanol
- Draagbare smartphone-add-on kan methanol in alcoholische dranken meten
 Nieuwe antimicrobiële therapieën om superbacteriën te bestrijden
Nieuwe antimicrobiële therapieën om superbacteriën te bestrijden Nanostructuren worden beter in het oogsten van zonlicht voor zonnestoomopwekking
Nanostructuren worden beter in het oogsten van zonlicht voor zonnestoomopwekking Welke soorten vlooien leven in Florida?
Welke soorten vlooien leven in Florida?  Nummers met gastartiesten:waarom ze succesvoller zijn
Nummers met gastartiesten:waarom ze succesvoller zijn Twee graden gedecimeerde insectenpopulaties in Puerto Rico
Twee graden gedecimeerde insectenpopulaties in Puerto Rico Professionele atleten presteren beter tegen hun voormalige clubs, zo blijkt uit onderzoek
Professionele atleten presteren beter tegen hun voormalige clubs, zo blijkt uit onderzoek Studie:pulserende oplossing gevonden in kristallen
Studie:pulserende oplossing gevonden in kristallen Waarom is C2H4-ethyleen niet-polair?
Waarom is C2H4-ethyleen niet-polair?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

