
Wetenschap
Welke factoren moeten gelijk zijn bij een omkeerbare chemische reactie bij evenwicht?
1. Voorwaartse en achterwaartse reactiepercentages:
Bij evenwicht wordt de voorwaartse reactiesnelheid (vorming van producten) gelijk aan de omgekeerde reactiesnelheid (vorming van reactanten). Dit betekent dat de concentraties van reactanten en producten in de loop van de tijd niet veranderen. Wiskundig gezien kan dit worden uitgedrukt als:
Voorwaartse reactiesnelheid =Omgekeerde reactiesnelheid
2. Evenwichtsconstante (Kc of Kp):
De evenwichtsconstante (Kc voor op concentratie gebaseerde reacties en Kp voor op druk gebaseerde reacties) is een constante waarde die de mate weerspiegelt waarin een reactie in beide richtingen verloopt. Bij evenwicht blijft de evenwichtsconstante constant en kan de waarde ervan worden berekend met behulp van de concentraties van reactanten en producten.
Voor een algemene reactie:
aA + bB ⇌ cC + dD
De evenwichtsconstante-uitdrukking is:
Kc =[C]^c [D]^d / [A]^a [B]^b
waarbij [A], [B], [C] en [D] de evenwichtsconcentraties van de respectieve soort vertegenwoordigen.
Merk op dat voor gasvormige reacties de evenwichtsconstante wordt uitgedrukt in termen van partiële drukken in plaats van concentraties.
Door deze gelijke factoren te handhaven bereikt een omkeerbare chemische reactie een toestand van dynamisch evenwicht, waarbij de onderlinge omzetting tussen reactanten en producten doorgaat, maar de algehele samenstelling van het systeem onveranderd blijft.
 China voert klimaatstrijd op met emissiehandelssysteem
China voert klimaatstrijd op met emissiehandelssysteem NASA-NOAA-satelliet vindt tropische cycloon Gelena geschoren
NASA-NOAA-satelliet vindt tropische cycloon Gelena geschoren Ernstige winterdroogte in Nepal precies voorspeld door model
Ernstige winterdroogte in Nepal precies voorspeld door model Hoe ijskoude polaire vortexexplosies verband houden met de opwarming van de aarde
Hoe ijskoude polaire vortexexplosies verband houden met de opwarming van de aarde New York zou plastic schuimcontainers over de hele staat kunnen verbieden onder het voorstel van Cuomo
New York zou plastic schuimcontainers over de hele staat kunnen verbieden onder het voorstel van Cuomo
Hoofdlijnen
- Kunstmatig leven
- Wat is de rol van enzymen in het metabolisme?
- Hoeveel cellen bevinden zich in de interfase?
- Als de contractiele vacuole niet meer werkt, zal het organisme afsterven, wat gebeurt er in de cel?
- Wat gebeurt er met switchgrass als de voedselreserves zijn uitgeput?
- Hoe zal klimaatverandering de arctische kariboes en rendieren beïnvloeden?
- Hoe schimmels de genetische samenstelling van bacteriën kunnen verbeteren
- Kunnen algen die 'arme leveranciers' zijn, koralen helpen terugkomen na het bleken?
- Wat is een herterozygoot individu dat één allel voor een ziekte heeft, maar er niet door wordt beïnvloed?
- Nieuwe methode om antibioticaresistentie bij microben te bestrijden

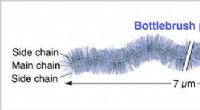
- 'S Werelds langste flessenborstelpolymeer ooit gesynthetiseerd
- Waterdraden kunnen een grotere rol spelen in de cellulaire functie

- Extreem actieve en selectieve geïmmobiliseerde katalysator voor elektrokatalytische reductie van kooldioxide

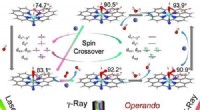
- Wetenschappers identificeren elektronische en structurele dynamiek van katalytische centra in materialen met één Fe-atoom
 De 120 jaar oude cold case voor de Grignard-reactie is eindelijk opgelost
De 120 jaar oude cold case voor de Grignard-reactie is eindelijk opgelost Hoe de menselijke verbinding met de natuur op te nemen in de biodiversiteitsdoelstellingen
Hoe de menselijke verbinding met de natuur op te nemen in de biodiversiteitsdoelstellingen  Wat is de rol van carotenoïden in fotosynthese?
Wat is de rol van carotenoïden in fotosynthese?  Storingen of niet, Nissan begint semi-autonome ritten te testen
Storingen of niet, Nissan begint semi-autonome ritten te testen Opvolging die plaatsvindt waar planten nog niet eerder zijn gegroeid, wordt genoemd?
Opvolging die plaatsvindt waar planten nog niet eerder zijn gegroeid, wordt genoemd?  Burgerwetenschappers uitgenodigd om mee te doen aan zoektocht naar nieuwe werelden
Burgerwetenschappers uitgenodigd om mee te doen aan zoektocht naar nieuwe werelden De diepte verkennen:hoe ijzersneeuw de geheimen van het leven op Europa kan ontsluieren
De diepte verkennen:hoe ijzersneeuw de geheimen van het leven op Europa kan ontsluieren  Bosbranden woeden over miljoen hectare terwijl hittegolf het westen van de VS verstikt, Canada
Bosbranden woeden over miljoen hectare terwijl hittegolf het westen van de VS verstikt, Canada
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

