
Wetenschap
Eén reden dat water een effectief oplosmiddel is?
1. Polariteit:Watermoleculen zijn polair, wat betekent dat ze een gedeeltelijk positieve lading hebben aan de ene kant van het molecuul en een gedeeltelijk negatieve lading aan de andere kant. Door deze polariteit kunnen watermoleculen waterstofbruggen vormen met andere polaire moleculen en ionen, deze oplossen en in oplossing houden.
2. Waterstofbinding:Waterstofbinding is een sterke intermoleculaire kracht die optreedt tussen watermoleculen en andere polaire moleculen of ionen. Deze waterstofbruggen helpen de moleculaire structuur van opgeloste stoffen af te breken, waardoor ze zich kunnen mengen en oplossen in water.
3. Hoge diëlektrische constante:De diëlektrische constante van een stof is een maatstaf voor het vermogen ervan om de elektrostatische krachten tussen geladen deeltjes te verminderen. Water heeft een hoge diëlektrische constante, wat betekent dat het de elektrostatische aantrekkingskracht tussen ionen effectief kan verminderen, waardoor ze in oplossing verspreid kunnen blijven.
4. Oppervlaktespanning:Water heeft een hoge oppervlaktespanning vanwege de sterke waterstofbinding tussen de moleculen. Deze oppervlaktespanning creëert een barrière aan het wateroppervlak, die bepaalde stoffen zoals oliën en vetten kan vasthouden en vasthouden, waardoor ze niet kunnen oplossen.
5. Temperatuurafhankelijke oplosbaarheid:De oplosbaarheid van veel stoffen in water neemt toe met de temperatuur. Dit komt omdat hogere temperaturen meer energie leveren om de interacties tussen opgeloste stof en oplosmiddel te overwinnen, waardoor meer opgeloste deeltjes in het water kunnen oplossen.
De polariteit van water, de waterstofbinding, de hoge diëlektrische constante, de oppervlaktespanning en de temperatuurafhankelijke oplosbaarheid maken het tot een effectief oplosmiddel voor een breed scala aan stoffen, waaronder anorganische zouten, organische verbindingen, suikers, zuren, basen en veel alledaagse materialen.
 Is roestvorming op de carrosserie een chemische reactie?
Is roestvorming op de carrosserie een chemische reactie?  Hete trillende gassen onder de elektronenschijnwerper
Hete trillende gassen onder de elektronenschijnwerper Nieuw onderzoek maakt de weg vrij voor het simuleren van katalysatoren onder reactieomstandigheden
Nieuw onderzoek maakt de weg vrij voor het simuleren van katalysatoren onder reactieomstandigheden Ingenieurs ontdekken nieuwe rol van water bij productie van hernieuwbare brandstoffen
Ingenieurs ontdekken nieuwe rol van water bij productie van hernieuwbare brandstoffen Wat zijn de temperatuurpatronen van de Gobi-woestijn?
Wat zijn de temperatuurpatronen van de Gobi-woestijn?
 Federale studie:nieuwe klimaatwet om koolstofvervuiling te verminderen met 40%
Federale studie:nieuwe klimaatwet om koolstofvervuiling te verminderen met 40% Studie bekijkt hoe landaankopen de klimaatverandering beïnvloeden
Studie bekijkt hoe landaankopen de klimaatverandering beïnvloeden Bodemsoorten in gematigde loofbossen
Bodemsoorten in gematigde loofbossen Extreem veldwerk, drones, klimaatmodellering levert nieuwe inzichten op over de smeltende ijskap van Groenland
Extreem veldwerk, drones, klimaatmodellering levert nieuwe inzichten op over de smeltende ijskap van Groenland Door overstromingen getroffen Pakistan wordt geconfronteerd met verspreiding van infectieziekten
Door overstromingen getroffen Pakistan wordt geconfronteerd met verspreiding van infectieziekten
Hoofdlijnen
- Indringende vraag:Waarom worden albino's altijd als schurken neergezet?
- Soorten redeneren in geometrie
- Waar bevinden zich delen van het chloroplast-ATP-synthase die betrokken zijn bij de fosforylering van ADP naar ATP?
- Waarom wetenschappers een ondergronds mysterie willen oplossen over waar microben leven
- Wat inktvisneuronen en een octopus in extase ons over onszelf kunnen leren
- Inzicht in de manier waarop bruinrotschimmels hout afbreken, zou kunnen leiden tot nieuwe hulpmiddelen voor een efficiëntere productie van biobrandstoffen
- Hoe nitraat de genexpressie in peulvruchten reguleert
- Wat maakt clowns zo griezelig?
- Hoe het brein van Albert Einstein werkte
- Polymeerfilm beschermt tegen elektromagnetische straling, signaal interferentie

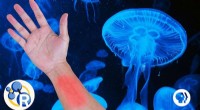
- Video:Moet je plassen op een kwallensteek?
- Gegevensopslag met behulp van individuele moleculen

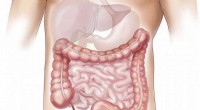
- Hoe de dikke darm prioriteit geeft aan gasontgifting boven energieverbruik?
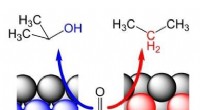
- Omzetting van hernieuwbare grondstoffen op platina vertoont onverwacht gedrag
 Klimaatverandering kan leiden tot grotere algenbloei
Klimaatverandering kan leiden tot grotere algenbloei Lab op een chip kan gezondheid monitoren, ziektekiemen en verontreinigende stoffen
Lab op een chip kan gezondheid monitoren, ziektekiemen en verontreinigende stoffen Een mijlpaal in het magnetische geheugen markeren
Een mijlpaal in het magnetische geheugen markeren Amerikaanse burgemeesters omzeilen Trump om klimaatdoelen van Parijs te steunen
Amerikaanse burgemeesters omzeilen Trump om klimaatdoelen van Parijs te steunen Adams,
Adams,  Hoe astronomen de mysterieuze oorsprong van superlichtgevende supernova's samenvoegen
Hoe astronomen de mysterieuze oorsprong van superlichtgevende supernova's samenvoegen Zal helderder licht meer elektronen uit een lichtgevoelig oppervlak werpen dan een dimmer met dezelfde frequentie?
Zal helderder licht meer elektronen uit een lichtgevoelig oppervlak werpen dan een dimmer met dezelfde frequentie?  Britse parlementsleden vragen Facebooks Zuckerberg om te getuigen over datarij
Britse parlementsleden vragen Facebooks Zuckerberg om te getuigen over datarij
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

