
Wetenschap
Hebben atomen dezelfde eigenschappen als een element?
1. Bulkeigenschappen:
Elementen in hun bulkvorm (dat wil zeggen macroscopische hoeveelheden) vertonen collectieve eigenschappen die het resultaat zijn van de interacties en rangschikkingen van een groot aantal atomen. Deze eigenschappen zijn mogelijk niet direct waarneembaar in individuele atomen.
2. Verbinding en interacties:
Atomen binnen een element kunnen verschillende soorten chemische bindingen aangaan, waardoor hun eigenschappen aanzienlijk kunnen veranderen. Koolstofatomen kunnen bijvoorbeeld covalente bindingen vormen om diverse allotropen zoals grafiet en diamant te produceren, elk met verschillende fysische en chemische eigenschappen.
3. Kristalstructuur:
Elementen kunnen in verschillende kristalstructuren voorkomen, waarbij atomen in specifieke patronen zijn gerangschikt. Variaties in de kristalstructuur kunnen de eigenschappen van het element beïnvloeden, zoals de dichtheid, hardheid en elektrische geleidbaarheid.
4. Kwantumeffecten:
Op het gebied van de kwantummechanica kunnen individuele atomen kwantumgedrag vertonen dat misschien niet duidelijk zichtbaar is in grotere verzamelingen. Fenomenen zoals elektronenspin, kwantisering van energieniveaus en superpositie zijn enkele voorbeelden van kwantumeigenschappen die het gedrag van atomen kunnen beïnvloeden.
5. Fasegedrag:
Elementen kunnen in verschillende fasen voorkomen, waaronder vast, vloeibaar en gas. De eigenschappen van een element kunnen drastisch variëren, afhankelijk van de fase ervan. Water (H2O) vertoont bijvoorbeeld unieke eigenschappen als vaste stof (ijs), vloeistof (water) en gas (waterdamp).
Hoewel atomen de fundamentele kenmerken van een element dragen, kunnen hun eigenschappen dus worden beïnvloed door factoren zoals binding, interacties, arrangementen, kwantumeffecten en fasegedrag. Het begrijpen van deze nuances is cruciaal in veel wetenschapsgebieden, waaronder scheikunde, materiaalkunde en natuurkunde.
 Nieuwe innovatieve statistische tool verbetert de bestrijding van vervuiling in steden
Nieuwe innovatieve statistische tool verbetert de bestrijding van vervuiling in steden Studie vindt grote besparingen bij het verwijderen van dammen boven reparaties
Studie vindt grote besparingen bij het verwijderen van dammen boven reparaties Hoe vakantiefoto's van zebra's en walvissen kunnen bijdragen aan natuurbehoud
Hoe vakantiefoto's van zebra's en walvissen kunnen bijdragen aan natuurbehoud  Het klimaat van de staat China in 2018:meer extreme gebeurtenissen, maar minder verlies
Het klimaat van de staat China in 2018:meer extreme gebeurtenissen, maar minder verlies De positieve kanten van klimaatverandering? Onderzoek toont agrarische, economische mogelijkheden
De positieve kanten van klimaatverandering? Onderzoek toont agrarische, economische mogelijkheden
Hoofdlijnen
- Eenvoudig model verklaart waarom verschillende vierpotige dieren vergelijkbare gangen aannemen
- Vrouwelijke makaak in Italiaans heiligdom heeft haar gemummificeerde dode baby opgegeten
- Welk weefsel vormt de aveoli?
- Wat is het Baader-Meinhof-fenomeen?
- Wat gebeurde er met het brein van Einstein nadat hij stierf?
- Nieuwe ontdekking daagt lang gekoesterde evolutietheorie uit
- Vis uit het water:hoe killifish-embryo's hun ontwikkeling aanpassen
- Hoe hersenspoeling werkt
- Hoe ondersteunen verschillende omgevingen variëteiten van organismen?
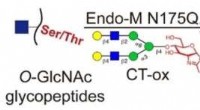
- Reversibele chemo-enzymatische labelstrategie maakt diepgaande analyse van eiwit O-GlcNAcylation mogelijk
- Nieuwe MOF is potentiële next-gen halfgeleider
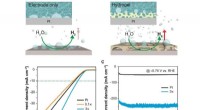
- Superaerofobe hydrogels voor verbeterde elektrochemische en foto-elektrochemische waterstofproductie
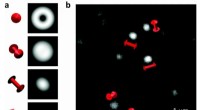
- Nieuwe beeldvormingstechniek onthult hoe mechanische schade begint op moleculaire schaal
- Chemicus suggereert een manier om de smaak van bier te meten
 Coyotes in New York City hoeven niet afhankelijk te zijn van menselijke voeding
Coyotes in New York City hoeven niet afhankelijk te zijn van menselijke voeding Wat kan glycolyse stoppen?
Wat kan glycolyse stoppen?  Nieuwe thermometer kan de ontwikkeling van kwantumcomputers versnellen
Nieuwe thermometer kan de ontwikkeling van kwantumcomputers versnellen Klimaatverandering kan droogte veroorzaken in gebieden waar tarwe wordt verbouwd:studie
Klimaatverandering kan droogte veroorzaken in gebieden waar tarwe wordt verbouwd:studie Vier manieren waarop blockchain het internet veiliger kan maken, eerlijker en creatiever
Vier manieren waarop blockchain het internet veiliger kan maken, eerlijker en creatiever Hoe duurzaam is tonijn? Nieuwe mondiale vangstdatabank legt gevaarlijke visserijtrends bloot
Hoe duurzaam is tonijn? Nieuwe mondiale vangstdatabank legt gevaarlijke visserijtrends bloot  Google neemt het op tegen Apple Arcade met mobiele gameservice
Google neemt het op tegen Apple Arcade met mobiele gameservice Magnetische monopolen bevriezen:hoe dipolen monopolen worden en omgekeerd
Magnetische monopolen bevriezen:hoe dipolen monopolen worden en omgekeerd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

