
Wetenschap
Waarom is jodium minder reactief dan broom?
1. Atomische grootte: Jodium heeft een grotere atoomgrootte dan broom. Naarmate de atomaire grootte toeneemt, neemt ook de afstand tussen de kern en de buitenste elektronen toe. Dit resulteert in een afname van de effectieve nucleaire lading die de buitenste elektronen ervaren. Als gevolg hiervan worden de buitenste elektronen in jodium losser vastgehouden en minder reactief vergeleken met broom.
2. Polariseerbaarheid: Polariseerbaarheid is het vermogen van een atoom of molecuul om zijn elektronenwolk te vervormen als reactie op een extern elektrisch veld. Jodium is minder polariseerbaar dan broom. Dit betekent dat de elektronenwolk van jodium steviger wordt vastgehouden en minder gevoelig is voor vervorming. Als gevolg hiervan is jodium minder reactief ten opzichte van elektrofielen (soorten die zich aangetrokken voelen tot elektronen) vergeleken met broom.
3. Energie voor bindingsdissociatie: De bindingsdissociatie-energie van jodium is groter dan die van broom. Dit betekent dat er meer energie nodig is om de I-I-binding in jodium te verbreken vergeleken met de Br-Br-binding in broom. Als gevolg hiervan is het minder waarschijnlijk dat jodium splitsing van homolytische bindingen ondergaat, wat een gebruikelijk reactiepad is voor veel chemische reacties.
Samenvattend dragen de grotere atomaire omvang, de lagere polariseerbaarheid en de hogere bindingsdissociatie-energie van jodium bij aan de verminderde reactiviteit ervan in vergelijking met broom.
 Een materiaal met een bijzondere twist:2-D molybdeendiselenidekristal
Een materiaal met een bijzondere twist:2-D molybdeendiselenidekristal Kun je het kookpunt van een vloeistof veranderen?
Kun je het kookpunt van een vloeistof veranderen?  Bewijs van waterdraden gemotiveerd door een biologisch waterkanaal
Bewijs van waterdraden gemotiveerd door een biologisch waterkanaal Hoeveel dagen duurt het voordat 32 gram palladium -103 vervalt. 2,0 De halfwaardetijd is 17 dagen?
Hoeveel dagen duurt het voordat 32 gram palladium -103 vervalt. 2,0 De halfwaardetijd is 17 dagen?  Lesprogramma's van de 1e graad voor eigenschappen van de materie
Lesprogramma's van de 1e graad voor eigenschappen van de materie
 Science Fair Ideas With Horses
Science Fair Ideas With Horses  Groene daken verbeteren de stedelijke omgeving – dus waarom hebben niet alle gebouwen ze?
Groene daken verbeteren de stedelijke omgeving – dus waarom hebben niet alle gebouwen ze?  Wat zijn de overtuigingen over de oorzaken van ziekte tijdens de Elizabethaanse periode?
Wat zijn de overtuigingen over de oorzaken van ziekte tijdens de Elizabethaanse periode?  NASA volgt tropische storm Talim in Filippijnse Zee
NASA volgt tropische storm Talim in Filippijnse Zee Breed draagvlak voor ambitieus klimaatbeleid als aan vier voorwaarden wordt voldaan
Breed draagvlak voor ambitieus klimaatbeleid als aan vier voorwaarden wordt voldaan
Hoofdlijnen
- Dingo? Bingo! Hoe je dingo vanuit je huis kunt helpen met onderzoek
- Sumatraanse tijgers op weg naar herstel in gevaar UNESCO-werelderfgoed
- De circadiane klok bepaalt het tempo van de plantengroei
- Wetenschapsprojecten over Dominant en Recessieve Genen
- Hoe ribosomen het proteoom vormen
- Vier klassen van macromoleculen belangrijk voor levende dingen
- Hoe blind zijn vleermuizen eigenlijk? Kleurvisiegenstudie onderzoekt belangrijke sensorische afwegingen
- Hoe ontrouw neven en nichten helpt:mannen delen mogelijk meer genen met de kinderen van zussen dan met vreemdgaande echtgenotes
- Live 3D-beeldvorming benadrukt cellulaire activiteit tijdens embryonale hartontwikkeling
- Stijve, pijnlijke knieën? In het laboratorium gemaakte kraakbeengel presteert beter dan het echte werk

- Enzymen ontdooid avontuur:in thermodynamica van kristallo-eiwitten
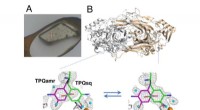
- Wetenschappers voorspellen nieuwe superharde materialen

- Topologiecontrole van menselijke fibroblastcellen monolaag door vloeibaar kristalelastomeer

- Ontwikkeling van een 3D-deeltjesmodel voor afzonderlijke deeltjes in batterij-elektroden
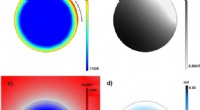
 Wetenschappers gebruiken een nieuw type nanodeeltje dat zowel vaccins kan afleveren als als adjuvans kan fungeren
Wetenschappers gebruiken een nieuw type nanodeeltje dat zowel vaccins kan afleveren als als adjuvans kan fungeren  Wat is de locatie van neutronen in atomen?
Wat is de locatie van neutronen in atomen?  Schone dieseluitlaat zonder platina?
Schone dieseluitlaat zonder platina?  De energietransformatie van een match
De energietransformatie van een match  Op microgolven gebaseerde testmethode kan helpen om de ogen van ontwerpers van 3D-chips open te houden
Op microgolven gebaseerde testmethode kan helpen om de ogen van ontwerpers van 3D-chips open te houden Onderzoekers ontwikkelen nieuwe sondes voor 3D-atoomkrachtmicroscopie
Onderzoekers ontwikkelen nieuwe sondes voor 3D-atoomkrachtmicroscopie Winnaars van de wedstrijd:Apple kiest de beste foto's die met de iPhone zijn gemaakt
Winnaars van de wedstrijd:Apple kiest de beste foto's die met de iPhone zijn gemaakt Het eerste voorbeeld van recycling op aarde:zijn eigen korst
Het eerste voorbeeld van recycling op aarde:zijn eigen korst
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

