Wetenschap
Enzymen ontdooid avontuur:in thermodynamica van kristallo-eiwitten
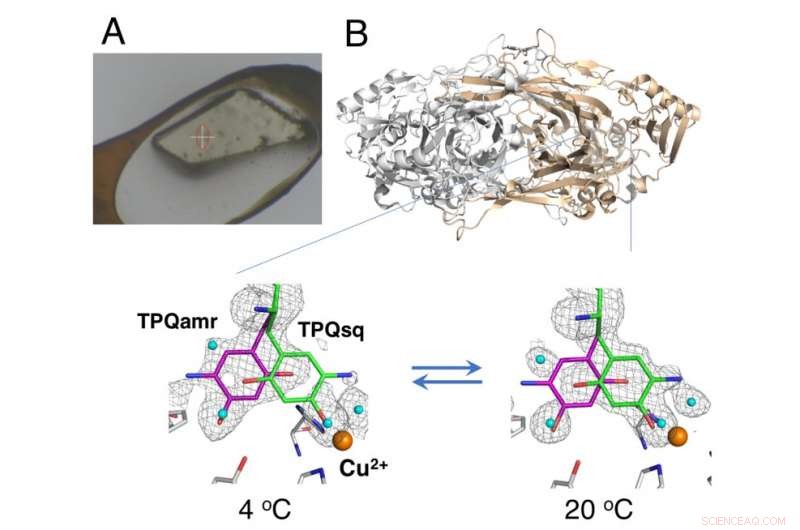
Niet-cryogekoeld kristal gemonteerd met behulp van de HAG-methode (A) en temperatuurafhankelijke evenwichtsverandering van katalytische tussenproducten in koperamineoxidase (B). Krediet:Universiteit van Osaka
Enzymen - biokatalysatoren gemaakt van eiwitten - zijn enorm belangrijke moleculen die de reacties en processen in levende organismen katalyseren. Voortdurend werk om hun structuren en reactiemechanismen te begrijpen is daarom van vitaal belang om onze kennis te verbreden en bij te dragen aan wetenschappelijke en medische vooruitgang.
Röntgenkristallografie - waarbij eiwitkristallen worden blootgesteld aan een röntgenstraal, wat resulteert in specifieke diffractiepatronen die kunnen worden geanalyseerd, is de meest gebruikte techniek voor het bepalen van de structuur van eiwitten. Gegevensverzameling in röntgenkristallografie omvat meestal het plaatsen van kristallen onder een cryogene gasstroom bij 100 K; echter, de cryogene omstandigheden laten over het algemeen geen thermodynamische analyse van de conformationele veranderingen in de eiwitkristallen toe. Nutsvoorzieningen, onderzoekers van de Universiteit van Osaka, Osaka Medisch College, Japan Synchrotron Radiation Research Institute (JASRI), en RIKEN hebben de details gerapporteerd van structurele veranderingen tijdens de katalytische reactie van een koperamineoxidase met behulp van een niet-cryogene techniek. Hun bevindingen werden gepubliceerd in PNAS .
De studie maakte gebruik van een "humid air and glue-coating (HAG)"-methode ontwikkeld door JASRI in de synchrotron-faciliteit SPring-8. In plaats van cryogene koeling, de niet-bevroren eiwitkristallen werden gecoat met een in water oplosbaar polymeer en onder een stroom vochtig stikstofgas geplaatst met een nauwkeurig gecontroleerde temperatuur. Hierdoor bleef het bijna kale kristal stabiel genoeg voor het team om het evenwicht tussen de structureel verschillende conformaties van de redox-cofactor (een essentieel onderdeel van de katalytische reactie) bij een bepaalde temperatuur te beoordelen.
"Als resultaat van de nauwkeurige temperatuurregeling die we konden bereiken, we demonstreerden de eerste succesvolle in kristallo thermodynamische analyse van het werkende enzym, " zegt studie corresponderende auteur Toshihide Okajima. "Thermodynamische analyses op basis van kristalmetingen geven een betere weergave van de structurele veranderingen dan gegevens verkregen uit oplossingsstudies, en zijn daarom waardevoller voor ons begrip."
In aanvulling, de verkregen thermodynamische parameters vertoonden een gedrag dat vergelijkbaar was met dat in cytosol in cellen. Daarom wordt aangenomen dat de HAG-condities een bruikbaar model kunnen zijn voor fysiologische condities. Er zijn verschillende andere kristallografische technieken beschreven voor gebruik bij omgevingstemperatuur; echter, ze vereisen gespecialiseerde röntgenvrije lasers.
"Door de temperatuurgecontroleerde HAG-methode te gebruiken, we hebben aangetoond dat het mogelijk is om conformationele informatie te verkrijgen met behulp van een standaard röntgenstraal, " legt Okajima uit. "We hopen dat de toegankelijkheid van de techniek en de mogelijkheden voor het verstrekken van thermodynamische informatie het een belangrijke aanvulling zullen maken op de huidige kristallografische benaderingen."
 Elektronische neus om honden te snuffelen voor dodelijke tropische ziekte in Brazilië
Elektronische neus om honden te snuffelen voor dodelijke tropische ziekte in Brazilië Korte totale synthese van ajoen, een biologisch actieve component in olie-extracten van knoflook
Korte totale synthese van ajoen, een biologisch actieve component in olie-extracten van knoflook De uitkomst van de wapenwedloop tussen mens en bacterie voorspellen
De uitkomst van de wapenwedloop tussen mens en bacterie voorspellen Vier soorten orbitalen en hun vormen
Vier soorten orbitalen en hun vormen C. elegans rondwormen oogsten een essentieel co-enzym uit de bacteriën die ze consumeren
C. elegans rondwormen oogsten een essentieel co-enzym uit de bacteriën die ze consumeren
 Onderzoek onthult hoe fluitende doorn acaciaboom en patasaap lijken op de Truffula-boom en de Lorax
Onderzoek onthult hoe fluitende doorn acaciaboom en patasaap lijken op de Truffula-boom en de Lorax Om vulkaanuitbarstingen onder water te voorspellen, wetenschapper kijkt naar beelden vanuit de ruimte
Om vulkaanuitbarstingen onder water te voorspellen, wetenschapper kijkt naar beelden vanuit de ruimte Een gemakkelijker leven voor de reuzeninktvis
Een gemakkelijker leven voor de reuzeninktvis Chinese vee-revolutie vereist nieuwe transitie
Chinese vee-revolutie vereist nieuwe transitie Lichte lagen zanderige as vallen in de buurt van uitbarstende Hawaii-vulkaan
Lichte lagen zanderige as vallen in de buurt van uitbarstende Hawaii-vulkaan
Hoofdlijnen
- Wat wordt geoxideerd en wat wordt er gereduceerd in celademhaling?
- Zelfs als je nog niet weet dat je ziek bent, je gezicht zal je verraden
- Bladcelstructuur
- Wat is interfase, metafase en anafase?
- Hoe kunnen nieuwe cellen iemands gezichtsvermogen herstellen?
- NASA Twins-onderzoek wordt gerepliceerd op Everest
- Doel van een Cell
- Wat zijn de vijf belangrijkste functies van het skeletsysteem?
- Individuele genomen van patiënten kunnen de werkzaamheid beïnvloeden, veiligheid van het bewerken van genen
 Waarom is condensatie belangrijk?
Waarom is condensatie belangrijk?  Ultrahoge gevoeligheid grafeen-infrarooddetectoren voor beeldvorming en spectroscopie
Ultrahoge gevoeligheid grafeen-infrarooddetectoren voor beeldvorming en spectroscopie Keramische kookpotten leggen geschiedenis vast van oude voedselpraktijken
Keramische kookpotten leggen geschiedenis vast van oude voedselpraktijken Witte dwerg-hoofdreeks binair geïdentificeerd in de open cluster NGC 752
Witte dwerg-hoofdreeks binair geïdentificeerd in de open cluster NGC 752 Nieuwe genen op verslechterend Y-chromosoom
Nieuwe genen op verslechterend Y-chromosoom Licht een kritische factor bij het beperken van de koolstofopname, zelfs in het noorden
Licht een kritische factor bij het beperken van de koolstofopname, zelfs in het noorden DNA-bewijs onthult twee vergeten Noord-Amerikaanse migraties
DNA-bewijs onthult twee vergeten Noord-Amerikaanse migraties  Twee nieuwe opgeblazen hete Jupiters ontdekt door astronomen
Twee nieuwe opgeblazen hete Jupiters ontdekt door astronomen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com