
Wetenschap
Topologiecontrole van menselijke fibroblastcellen monolaag door vloeibaar kristalelastomeer
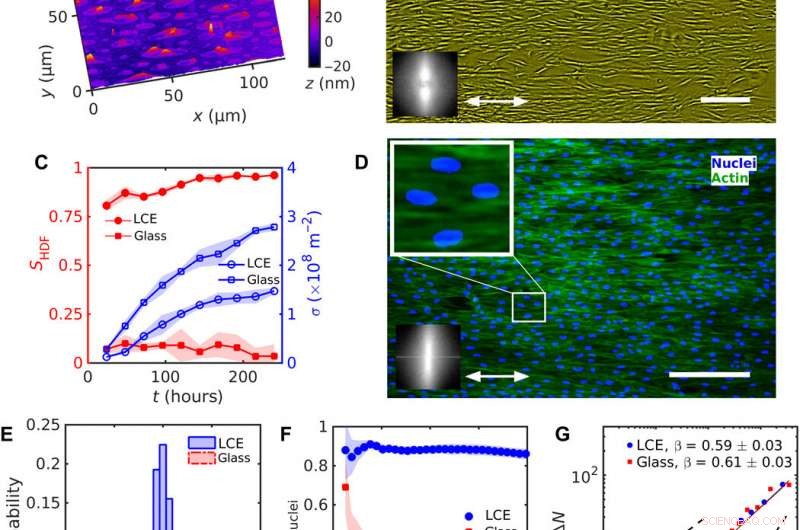
Uniforme uitlijning van HDF-cellen op LCE met een uniforme nˆLCE=const. (A) Digitale holografische microscopie (DHM) textuur van het LCE-oppervlak na contact met het waterige groeimedium. (B) Fasecontrastmicroscopie (PCM) textuur van HDF-cellen die 120 uur na het zaaien op LCE-substraten groeien. Tweekoppige pijl vertegenwoordigt nˆLCE. (C) Evolutie van de volgordeparameter SHDF van cellichamen (gevulde rode symbolen) en celdichtheid σ (lege blauwe symbolen). (D) Fluorescerende microscopische texturen van HDF-cellen op LCE; fluorescent gelabelde kernen (blauw) en cytoskelet F-actine-eiwitten (groen). Vergrote textuur toont langwerpige kernen die in dezelfde richting zijn georiënteerd als de lichamen van de cellen. Inzetstukken in (B) en (D) tonen snelle Fourier-transformatie van (B) PCM en (D) fluorescerende F-actine-texturen die de oriëntatievolgorde langs de uniforme nˆLCE aangeven. (E) Verdeling van de oriëntatie van kernen. (F) Afhankelijkheid van de volgordeparameter Snuclei van kernen op de grootte van een vierkant subvenster. (G) Aantal dichtheidsfluctuaties ΔN berekend voor het gemiddelde aantal celkernen 〈N〉. Schaalbalken, 300 urn. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaz6485
Eukaryote cellen in levende weefsels kunnen belangrijke fysiologische processen beïnvloeden, zoals apoptose en celmigratie op basis van dynamische patroonvorming met ruimtelijk variërende oriëntaties. Echter, het is nog een uitdaging om een vooraf ontworpen kaart van oriëntatieorde op een groeiend weefsel in het laboratorium te projecteren. In een nieuwe studie die nu is gepubliceerd op wetenschappelijke vooruitgang , Taras Turiv en een onderzoeksteam in chemische fysica, geavanceerde materialen en biomedische wetenschappen aan de Kent State University, Ohio, ONS., heeft een nieuwe benadering uitgewerkt om celmonolagen van menselijke dermale fibroblasten te produceren. Ze ontwierpen de oriëntatiepatronen en topologische defecten met behulp van een foto-uitgelijnd vloeibaar kristalelastomeer (LCE) dat anisotroop opzwol in een waterig medium. Het team schreef de patronen in de LCE in, en de weefselmonolaag repliceerde de patronen om sterke variaties in celfenotypes (grootte en vorm) te veroorzaken, hun oppervlaktedichtheid en aantal dichtheidsfluctuaties. De nieuwe benadering kan het collectieve gedrag van cellen in levende weefsels tijdens celdifferentiatie en weefselmorfogenese regelen voor brede toepassingen in bio-engineering en regeneratieve geneeskunde.
Cellen die levende weefsels vormen, vertonen vaak oriëntatievolgorde wanneer ze in nauw contact staan vanwege de onderlinge uitlijning van anisometrische cellen. De richting van de gemiddelde oriëntatie kan variëren in ruimte en tijd om topologische defecten te produceren die bekend staan als disclinaties. Dergelijke defecten kunnen in het weefsel bewegen om een belangrijke rol te spelen tijdens druk-dilatatieve spanningen en processen, inclusief dode celextractie. Het vermogen om een weefselscaffold van levende cellen te ontwerpen met oriëntatie en controle is belangrijk voor biomedische onderzoekers om levende materie te onderzoeken en te manipuleren. Wetenschappers hebben al geordende celassemblages geproduceerd op lithografisch vervaardigde oppervlakken, inclusief de randen van microkanalen, in microgroeven en oppervlakken met materiaalstijfheidsgradiënten. In dit werk, Turiv et al. ontworpen weefsels met een hoge mate van oriënterende orde en vooraf bepaalde ruimtelijk variërende richting, gebaseerd op een sjabloon van regisseurpatronen op LCE-substraten. Het team gebruikte menselijke dermale fibroblast (HDF) cellen als de bouweenheden van het sjabloonweefsel.
Materiaalkorrels dienen als geleidingsrail voor HDF-cellen. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaz6485
Fibroblasten zijn de meest voorkomende bindweefselcellen van zoogdieren en ze behouden meestal een platte langwerpige vorm met belangrijke rollen tijdens weefselherstel en -herstructurering, evenals wondgenezing. Wetenschappers kunnen deze cellen herprogrammeren tot pluripotente stamcellen voor veelbelovende toepassingen in diagnostiek en therapie. In dit werk, de gecombineerde effecten van celzaaien en deling van gedessineerde HDF-weefsels op vooraf ontworpen LCE-substraten produceerden confluente weefsels. De gestructureerde LCE had een duidelijke impact op het weefsel, waar ze het uitlijningspatroon en de ruimtelijke verdeling van cellen controleerden, hun dichtheid, schommelingen, en fenotype. De van een patroon voorziene LCE toonde locaties van topologische defecten in weefsels door anisotrope oppervlakte-interacties op vooraf bepaalde locaties. Omdat de cellulaire uitlijning en topologische defecten biochemische processen op microschaal kunnen beheersen, dit werk opent de mogelijkheid om oppervlakken te ontwerpen voor gecontroleerde weefselpatronen om ze te ontwerpen voor specifieke functies.
Tijdens de experimenten, Turiv et al. ondersteunde het LCE-substraat door een glasplaat en bedekte het met indiumtinoxide (ITO) om de oppervlakteruwheid te verminderen, gevolgd door een laag lichtgevoelige azokleurstof te coaten en uiteindelijk het substraat te bedekken met een waterig medium van celcultuur. De oppervlaktekorrels op het materiaal dienden als geleidingsrail voor HDF-cellen. Toen de HDF-cellen in celkweek werden gesuspendeerd, ze leken rond maar nadat ze in het substraat waren gezet, ze ontwikkelden een langwerpig uiterlijk. De wetenschappers registreerden samenvloeiing (groei) resultaten van gecombineerde effecten van celzaaien. De resultaten toonden aan dat de oriëntatievolgorde optrad als gevolg van directe interacties tussen cellen en het LCE-substraat. De substraten hielpen zowel lichamen als kernen van HDF-cellen uit te lijnen als een belangrijk kenmerk voor veel celfuncties, waaronder eiwitexpressie, beweeglijkheid, stofwisseling en differentiatie.

Patroonuitlijning van HDF-cellen op LCE met een (−1/2, +1/2) paar gebreken. (A) PolScope-textuur met nˆLCE en optische vertraging van LCE in contact met het celgroeimedium. (B en C) DHM-texturen van LCE-oppervlak in contact met het celgroeimedium met (B) −1/2 en (C) +1/2 defecten. (D) fluorescerend gekleurde HDF-cellen; 4′, 6-diamidino-2-fenylindol-gelabelde celkernen (blauw) en phalloidin-gelabelde actine cytoskeletfilamenten (groen). (E) De oppervlaktedichtheid van celkernen als de functie van afstand r van +1/2 (blauw) en −1/2 (rood) defecte kernen. (F) Grote aantal dichtheidsfluctuaties ΔN van de kernen in de buurt van defecte kernen. (G) PCM-beelden van HDF-cellen op LCE-substraat 240 uur na het zaaien. Blauwe en rode stippen geven de locatie van +1/2 en −1/2 defecte kernen aan, respectievelijk, verkregen uit gepolariseerde optische microscopie (POM) textuur van LCE. (H) Kleurgecodeerd oriëntatieveld en (I) het bijbehorende schema van gedessineerde HDF-weefselregisseur nˆHDF afgebeeld met PCM. Rode balken in (I) geven de lokale oriëntatie van de lange assen van cellen aan. (J) Scheiding tussen halfsterkte-defecten voor horizontale en verticale regisseur ertussen (zie fig. S6). Schaalbalken, 300 urn. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaz6485
De HDF-cellen op LCE organiseerden zichzelf in uitgelijnde assemblages volgens vooraf opgelegde aanwijzingen. Het team merkte op dat het gedrag van cellen en celdichtheid varieerde naarmate ze defectkernen en andere topologische inconsistenties (gebogen type defecten of splay-type defecten) op de LCE-substraten naderden. The substrates markedly impacted the HDF cells that were in contact with each other, resulting in collectively strong differences in the size and shape of cells. The marked differences indicated the influence of the predesigned patterns on the HDF cell phenotype (size and shape). Based on additional results, Turiv et al. credited the number density fluctuations in tissues to be influenced by the surface charge of director patterns and studied the issue in detail in a larger surface area.
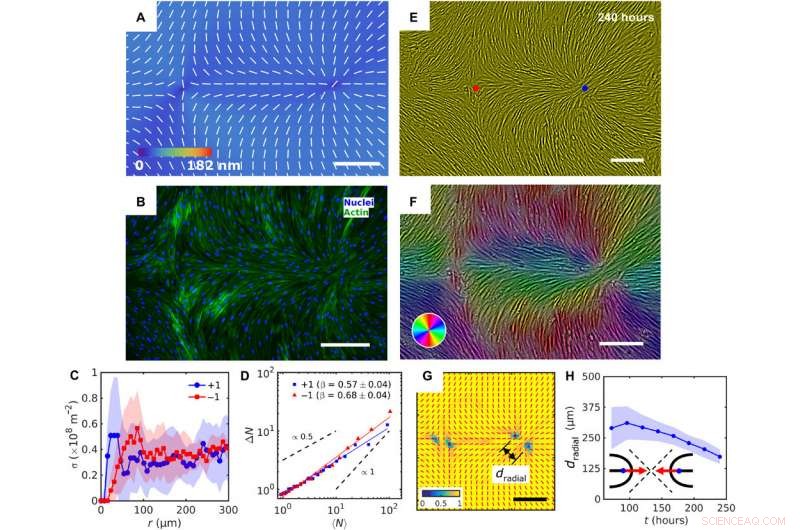
Patterned alignment of HDF cells on LCE predesigned with a pair of −1 and radial +1 (splay type) defects. (A) PolScope image of nˆLCE pattern of LCE in contact with the cell growth medium. (B) Fluorescently labeled HDF cells. (C) The surface density of cell nuclei σ as the function of distance from defect cores. (D) Large number density fluctuations ΔN with mean number of nuclei 〈N〉 showing a larger slope near −1 cores as compared to +1. (E) PCM textures of HDF cells on LCE layer at 240 hours after cell seeding. Red and blue dots denote location of −1 and +1 defects in patterned LCE obtained from crossed polarized textures. (F) Color-coded orientational field and (G) of the corresponding scheme of patterned HDF tissue director nˆHDF obtained from local anisotropy of PCM texture in (E). Red bars in (G) denote local orientation of cells’ long axes. (H) Time dependence of separation between two +1/2 defects near the +1 radial core. Schaalbalken, 300 μm. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaz6485
Op deze manier, Taras Turiv and colleagues showed the dynamics and propagation of defects in patterned tissues and how they could be halted through surface anchoring forces. The scientists used LCE substrates with photopatterned structures of varying molecular orientations to grow biological tissues with predesigned cell alignment. The substrates affected cell alignment as well as cell surface density and cell phenotypes. The team noted higher density of cells in defect cores with positive topological charge, while cell density was lower near negative defects. The cells mechanistically aligned to the substrates by swelling upon contact with the aqueous cell culture medium, followed by aligning to predesigned photopatterned direction. This approach will allow materials scientists and bioengineers to design biological tissues with predetermined cell alignment and precise location of orientational defects. The outcomes can facilitate controlled cell migration, differentiation. and apoptosis. The work can be further optimized to advance the understanding of fundamental mechanisms underlying tissue development and regeneration.

The orientational order of the assemblies in +1/2 and −1/2 disclinations. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaz6485
© 2020 Wetenschap X Netwerk
 De toekomst van plastic:het slechte hergebruiken en het goede aanmoedigen
De toekomst van plastic:het slechte hergebruiken en het goede aanmoedigen Hoe thermische uitzetting van Steel
Hoe thermische uitzetting van Steel Cementvrij beton verslaat corrosie en geeft fatbergs de flush
Cementvrij beton verslaat corrosie en geeft fatbergs de flush Wetenschappers ontwikkelen potentieel therapeutische gel, die stikstofmonoxide detecteert, absorbeert overtollig vocht en geeft medicijnen af
Wetenschappers ontwikkelen potentieel therapeutische gel, die stikstofmonoxide detecteert, absorbeert overtollig vocht en geeft medicijnen af Hoe ingesloten radicalen uit carboxyl te bevrijden?
Hoe ingesloten radicalen uit carboxyl te bevrijden?
 Hoe is gebotteld water een bijdrager voor opwarming van de aarde?
Hoe is gebotteld water een bijdrager voor opwarming van de aarde?  Hoe een kikker en een menselijk ademhalingssysteem te vergelijken
Hoe een kikker en een menselijk ademhalingssysteem te vergelijken  Nieuw onderzoek snijdt door de waas rond rookvrije tabaksproducten
Nieuw onderzoek snijdt door de waas rond rookvrije tabaksproducten Pebble Mine-ontwikkelaar beloofde rijkdom, maar verwacht $ 1,5 miljard subsidie van Alaskanen
Pebble Mine-ontwikkelaar beloofde rijkdom, maar verwacht $ 1,5 miljard subsidie van Alaskanen Ruilen waar gewassen worden verbouwd, zou 825 miljoen extra mensen kunnen voeden
Ruilen waar gewassen worden verbouwd, zou 825 miljoen extra mensen kunnen voeden
Hoofdlijnen
- Fotograaf legt menselijk gezicht van bedreigde diersoorten vast
- Cellen voelen en verkennen hun omgeving
- Wat zijn de functies van ureum?
- Jacht op herten beperkt in westelijke Amerikaanse staten na strenge winter
- Soorten monomeren
- Wat zijn de structurele delen van de lange botten in het lichaam?
- Typen morfologie
- Dodelijke vispathogeen gedetecteerd in Australië
- Verschillende soorten cellulaire communicatie
- Sommigen houden van cryogeen

- Gepersonaliseerde kankervaccins:doorbraak kan betere resultaten opleveren

- Katalytische koppelingen begrijpen:niet alle synergieën zijn eenvoudig
- Ingenieurs maken veelbelovend materiaal stabiel genoeg voor gebruik in zonnecellen

- Tweaks achter de wedergeboorte van bijna afgedankte organische zonnetechnologieën

 DNA-nanodeeltjes om medicijnen en gentherapie te dragen
DNA-nanodeeltjes om medicijnen en gentherapie te dragen Effecten van grondbewerking en bodembedekking op de graanproductie
Effecten van grondbewerking en bodembedekking op de graanproductie Het afstemmen van het oppervlak geeft variaties op metaalfolies
Het afstemmen van het oppervlak geeft variaties op metaalfolies Aantonen van vectoriële polaritonen door een nanosfeer in een optische holte te laten zweven
Aantonen van vectoriële polaritonen door een nanosfeer in een optische holte te laten zweven Een wrijvingsreductiesysteem voor vervormbare robotvingers
Een wrijvingsreductiesysteem voor vervormbare robotvingers Hybride nanoantennes - platform van de volgende generatie voor ultradichte gegevensregistratie
Hybride nanoantennes - platform van de volgende generatie voor ultradichte gegevensregistratie Sterke tanden:Nanostructuren onder stress maken tanden scheurbestendig
Sterke tanden:Nanostructuren onder stress maken tanden scheurbestendig Het aanbrengen van steenstof op akkerlanden kan tot 2 miljard ton CO2 uit de atmosfeer opnemen
Het aanbrengen van steenstof op akkerlanden kan tot 2 miljard ton CO2 uit de atmosfeer opnemen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

