
Wetenschap
Welke binding heeft geen dipoolmoment A. N-H B.O-H C.F-H D.H-H E.S-H?
Dipoolmoment is een maat voor de polariteit van een binding. Het wordt gedefinieerd als het product van de lading en de afstand tussen de ladingen. Bij een covalente binding worden de elektronen gedeeld tussen de twee atomen. Als de elektronen gelijkelijk worden gedeeld, is de binding niet-polair. Als de elektronen ongelijk verdeeld zijn, is de binding polair. De elektronegativiteit van een atoom is een maatstaf voor zijn vermogen om elektronen aan te trekken. Hoe groter het elektronegativiteitsverschil tussen twee atomen, hoe polairder de binding zal zijn.
Van de vijf genoemde obligaties is H-H de enige die niet-polair is. Dit komt omdat waterstof een zeer lage elektronegativiteit heeft. De andere vier bindingen zijn allemaal polair, waarbij het elektronegatieve atoom een gedeeltelijk negatieve lading heeft en het elektropositieve atoom een gedeeltelijk positieve lading heeft.
 Is calciumoxide een covalent gebonden verbinding of een ionische verbinding?
Is calciumoxide een covalent gebonden verbinding of een ionische verbinding?  Chemische reacties die licht produceren
Chemische reacties die licht produceren  Zilveroxide plus zoutzuur is gelijk aan?
Zilveroxide plus zoutzuur is gelijk aan?  Een squishy Rubiks Cube die chemici hebben gebouwd van polymeren, belooft veel voor gegevensopslag
Een squishy Rubiks Cube die chemici hebben gebouwd van polymeren, belooft veel voor gegevensopslag Een nieuw proces om metallurgische slakken te recyclen
Een nieuw proces om metallurgische slakken te recyclen
 Giftige bosbrandnevel bedekt Oost-Australië
Giftige bosbrandnevel bedekt Oost-Australië Een visionaire aanpak:hoe een team toegankelijke kaarten ontwikkelde voor kleurenblinde wetenschappers
Een visionaire aanpak:hoe een team toegankelijke kaarten ontwikkelde voor kleurenblinde wetenschappers  Californië staat bekend om aardbevingen en bosbranden, maar vergeet de vulkanen niet
Californië staat bekend om aardbevingen en bosbranden, maar vergeet de vulkanen niet Lijst met buideldieren
Lijst met buideldieren Aqua-satelliet ziet orkaan Michael sterker worden
Aqua-satelliet ziet orkaan Michael sterker worden
Hoofdlijnen
- Welke functionele groepen bevinden zich in cellulose?
- Hoe werken Mexicaanse springbonen?
- Timing van migratie verandert voor zangvogels aan de Pacifische kust
- Onderzoekers publiceren een gids over de genaturaliseerde en invasieve planten van Malawi
- Hoe een biologisch diagram te tekenen
- Nieuwe studie geeft aan hoe bevruchting veranderingen teweegbrengt in duizenden eiwitten in kikkereieren
- Finse tovenaars maken voedsel uit het niets
- 2 kiwivogels zijn zeldzaam lichtpuntje in grimmig uitstervingsrapport
- Kan een Vision Board uw toekomst echt beïnvloeden?
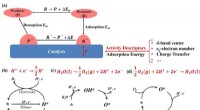
- Activiteitsbeschrijvingen voor elektrokatalysatoren in toepassingen voor energieopslag
- Het vinden van nieuwe biogebaseerde producten uit lignine zou kunnen helpen om van plastic af te komen

- Op polymeer gebaseerde coatings op metalen implantaten verbeteren de integratie van bot-implantaten
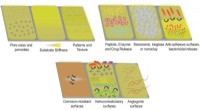
- Maak een sprong voorwaarts in de ontdekking en ontwikkeling van nieuwe antibiotica

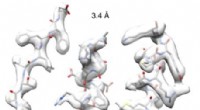
- Cryo-EM-beelden met hoge resolutie uit Afrika effenen de weg naar op maat gemaakte nitrilasen voor de industrie
 Onderzoekers gebruiken satellietbeelden om het grondwatergebruik in de centrale vallei van Californië in kaart te brengen
Onderzoekers gebruiken satellietbeelden om het grondwatergebruik in de centrale vallei van Californië in kaart te brengen Hoe kinesiotape werkt
Hoe kinesiotape werkt  250, 000 inwoners van Melbourne verliezen water door houtkap
250, 000 inwoners van Melbourne verliezen water door houtkap Vijftig jaar lang hebben massale opsluitingen Amerikaanse gezinnen geschaad. Hier ziet u hoe u dit kunt wijzigen
Vijftig jaar lang hebben massale opsluitingen Amerikaanse gezinnen geschaad. Hier ziet u hoe u dit kunt wijzigen  Nieuwe coronavirusvariant:wat is het spike-eiwit en waarom zijn mutaties erop belangrijk?
Nieuwe coronavirusvariant:wat is het spike-eiwit en waarom zijn mutaties erop belangrijk?  Het opruimen van ruïnes lanceert een nieuwe fase in het opruimen van brand in Californië
Het opruimen van ruïnes lanceert een nieuwe fase in het opruimen van brand in Californië Vooruitgang en uitdagingen bij het begrijpen van samengestelde weers- en klimaatextremen
Vooruitgang en uitdagingen bij het begrijpen van samengestelde weers- en klimaatextremen  Wetenschappers printen beeldsonde op nanoschaal op punt van optische vezel
Wetenschappers printen beeldsonde op nanoschaal op punt van optische vezel
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

