
Wetenschap
Wat is het verschil tussen covalente en ionenbindingen?
1. Covalente obligaties:
- Vorming:Covalente bindingen ontstaan wanneer twee of meer atomen een of meer elektronenparen delen.
- Elektronen delen:Het delen van elektronen creëert een sterke aantrekkingskracht tussen de atomen, waardoor ze bij elkaar worden gehouden.
- Elektronegativiteit:De elektronegativiteit van de betrokken atomen bepaalt het type covalente binding. Elektronegativiteit is het vermogen van een atoom om elektronen naar zichzelf toe te trekken.
- Bindingssterkte:Covalente bindingen zijn over het algemeen sterker dan ionische bindingen vanwege het wederzijds delen van elektronen.
- Voorbeelden:Voorbeelden van covalente bindingen zijn waterstofgas (H-H), methaan (CH4) en water (H2O).
2. Ionische bindingen:
- Vorming:Ionische bindingen ontstaan wanneer een of meer elektronen van het ene atoom naar het andere worden overgedragen, wat resulteert in de vorming van positief geladen ionen (kationen) en negatief geladen ionen (anionen).
- Elektronenoverdracht:De volledige overdracht van elektronen leidt tot elektrostatische aantrekking tussen de tegengesteld geladen ionen, waardoor ze bij elkaar worden gehouden.
- Elektronegativiteit:Ionische bindingen brengen doorgaans een significant verschil in elektronegativiteit met zich mee tussen de betrokken atomen.
- Bindingssterkte:Ionische bindingen zijn over het algemeen zwakker dan covalente bindingen vanwege de elektrostatische aard van de aantrekkingskracht tussen ionen.
- Voorbeelden:Voorbeelden van ionische bindingen zijn natriumchloride (NaCl), kaliumfluoride (KF) en calciumoxide (CaO).
Samenvattend omvatten covalente bindingen het delen van elektronen tussen atomen, terwijl ionische bindingen de volledige overdracht van elektronen met zich meebrengen, resulterend in de vorming van ionen. Covalente bindingen zijn sterker en komen vaker voor in niet-metalen elementen, terwijl ionische bindingen zwakker zijn en vaker voorkomen in verbindingen gevormd tussen metalen en niet-metalen.
 Geneesmiddelen en producten voor persoonlijke verzorging opzuigen uit water
Geneesmiddelen en producten voor persoonlijke verzorging opzuigen uit water Volgende stap in het produceren van magnetische organische moleculen
Volgende stap in het produceren van magnetische organische moleculen Lipidenasymmetrie speelt een sleutelrol bij het activeren van immuuncellen
Lipidenasymmetrie speelt een sleutelrol bij het activeren van immuuncellen Het legeringsstaalproductieproces
Het legeringsstaalproductieproces Wetenschappers onthullen dynamische zilverkristallisatie door in-situ SEM
Wetenschappers onthullen dynamische zilverkristallisatie door in-situ SEM
 Kopen, lenen of leasen:kunnen we heroverwegen hoe en wanneer we toegang krijgen tot huishoudelijke producten om klimaatverandering aan te pakken?
Kopen, lenen of leasen:kunnen we heroverwegen hoe en wanneer we toegang krijgen tot huishoudelijke producten om klimaatverandering aan te pakken? De hittegolf in het westen van de VS neemt af, maar meer brandgevaar in het verschiet:voorspelling
De hittegolf in het westen van de VS neemt af, maar meer brandgevaar in het verschiet:voorspelling Suomi NPP-satelliet ziet compacte storm Son-Tinh op weg naar Vietnam
Suomi NPP-satelliet ziet compacte storm Son-Tinh op weg naar Vietnam Geofysici ontwikkelen kaart met hoge resolutie van het magnetische veld van de aarde
Geofysici ontwikkelen kaart met hoge resolutie van het magnetische veld van de aarde Ex-tropische cycloon Ann beweegt over het Australische schiereiland Cape York
Ex-tropische cycloon Ann beweegt over het Australische schiereiland Cape York
Hoofdlijnen
- Hoe de ‘loopbandband’ zorgt voor een goede celdeling
- Het verschil tussen histon en nonhistone
- Is uw hond agressief? Een dierenarts legt 'woedesyndroom' uit
- Stappen van DNA Transcriptie
- De rol van enzymen in chemische reacties
- Hoe heeft de uitvinding van de microscoop bijgedragen aan de ontwikkeling van celtheorie?
- Parasitaire ooginfectie vormt een aanzienlijke bedreiging voor Britse honden, waarschuw experts
- Onderzoekers ontdekken dat hnRNPM de integriteit van de cellulaire eiwitproductie bewaakt
- Rechts- of linkshandig? Genexpressie vertelt het verhaal van de evolutie van de slak
- Onderzoek onthult het corrosiemechanisme van magnesiumlegeringen in een atmosferische mariene omgeving

- Nieuwe ontdekking helpt autoriteiten de herkomst van heroïne te achterhalen

- Alzheimerziekte zorgt ervoor dat cellen oververhit raken en bakken als eieren
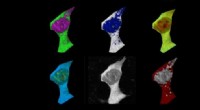
- Nieuwe lipidevormatlas is de sleutel tot vroege ziektedetectie

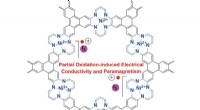
- Nieuw 2D metalen organisch raamwerk met interessante elektrische geleidbaarheid en magnetische eigenschappen
 Een Alaskan Judge heeft net een offshore boren verbannen - Heres Why That Matters
Een Alaskan Judge heeft net een offshore boren verbannen - Heres Why That Matters  Meerdere stellaire populaties gedetecteerd in de cluster Hodge 6
Meerdere stellaire populaties gedetecteerd in de cluster Hodge 6 Op sociale media, pleeggezinnen deelden hun zorgen over pandemie
Op sociale media, pleeggezinnen deelden hun zorgen over pandemie Wat zijn twee typen endoplasmatisch reticulum?
Wat zijn twee typen endoplasmatisch reticulum?  Metasurface ontworpen om drie verschillende afbeeldingen te maken, afhankelijk van de verlichting
Metasurface ontworpen om drie verschillende afbeeldingen te maken, afhankelijk van de verlichting NASA-studie verifieert trends in de opwarming van de aarde
NASA-studie verifieert trends in de opwarming van de aarde Kus je bier vaarwel als de klimaatverandering niet wordt aangevinkt
Kus je bier vaarwel als de klimaatverandering niet wordt aangevinkt  Hoe het markeren van genen vóór de celdeling hun daaropvolgende reactivering versnelt
Hoe het markeren van genen vóór de celdeling hun daaropvolgende reactivering versnelt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

