
Wetenschap
Hoe gedragen gassen zich?
Wet van Boyle (omgekeerde relatie tussen druk en volume):
- Stelt dat de druk van een gas omgekeerd evenredig is met het volume ervan wanneer de temperatuur en de hoeveelheid gas constant blijven.
- Als het volume van een gasfles afneemt, neemt de druk toe, en omgekeerd.
- Wiskundig gezien wordt de wet van Boyle uitgedrukt als P1V1 =P2V2.
Wet van Charles (directe relatie tussen volume en temperatuur):
- Beschrijft de relatie tussen het volume en de temperatuur van een gas bij constante druk en een vaste hoeveelheid gas.
- Naarmate de temperatuur stijgt, neemt ook het volume van een gas toe, en naarmate de temperatuur daalt, neemt het volume af.
- Wiskundig wordt de wet van Charles uitgedrukt als V1/T1 =V2/T2.
De wet van Gay-Lussac (directe relatie tussen druk en temperatuur):
- Legt uit hoe de druk van een gas recht evenredig is met de temperatuur wanneer het volume en de hoeveelheid gas constant blijven.
- Als de temperatuur van een gas stijgt, neemt de druk proportioneel toe, en als de temperatuur daalt, neemt de druk af.
- Wiskundig gezien wordt de wet van Gay-Lussac uitgedrukt als P1/T1 =P2/T2.
Wet van Avogadro (Gelijke volumes bevatten een gelijk aantal moleculen):
- Stelt dat gelijke volumes gassen bij dezelfde temperatuur en druk een gelijk aantal moleculen bevatten.
- Als het volume van een gasfles toeneemt terwijl de temperatuur en de druk constant blijven, neemt het aantal moleculen in dat volume af, en omgekeerd.
Daltons wet van partiële druk:
- Legt uit hoe de totale druk van een mengsel van gassen gelijk is aan de som van de partiële drukken die worden uitgeoefend door elk afzonderlijk gas in het mengsel.
- De partiële druk van een gas is de druk die het zou uitoefenen als het alleen het hele volume zou innemen bij dezelfde temperatuur.
Kinetische moleculaire theorie:
- Beschrijft het gedrag van gassen op microscopisch niveau. Er staat dat:
- Gasdeeltjes zijn voortdurend in beweging en bewegen willekeurig in alle richtingen.
- Gasdeeltjes botsen met elkaar en met de wanden van hun container.
- Deze botsingen zijn elastisch, wat betekent dat de totale energie van het systeem behouden blijft.
- De gemiddelde kinetische energie van gasdeeltjes is evenredig met de temperatuur van het gas.
Deze wetten en theorieën verklaren gezamenlijk het gedrag van gassen, waardoor we kunnen voorspellen en begrijpen hoe ze reageren op veranderingen in druk, volume, temperatuur en samenstelling.
Hoofdlijnen
- Mexico zegt dat de bedreigde vaquita-bruinvis in gevangenschap is gestorven
- Onderzoek onthult nieuw inzicht in hoe cheeta's hun prooi vangen
- Wat gebeurt er als de cellen zich ongecontroleerd voortplanten?
- Ecologische soortvorming door seksuele selectie op goede genen:is adaptief?
- Wetenschappers werken aan een periodiek systeem voor ecologie
- Hoe een vormveranderende receptor de celgroei beïnvloedt
- Hoe bacteriën bacteriofagen in vivo ontwijken
- Zijn dieren nog in ontwikkeling?
- Cultuur assimileren – wat taal ons vertelt over immigratie en integratie
- Structuur van de belangrijkste hersenreceptor die het behandeldoel is voor epilepsie, angst opgelost
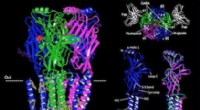
- Een belangrijke stap in de fotosynthetische zuurstofproductie ontrafelen

- Doorbraak kunstmatige fotosynthese komt dichterbij

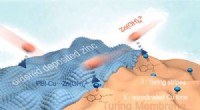
- Turing-membraan om de prestaties van op zink gebaseerde batterijen te verbeteren
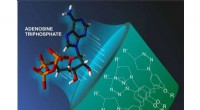
- Vallen voor energiebronmoleculen in cellen
 Is natuurkunde ooit deterministisch geweest?
Is natuurkunde ooit deterministisch geweest? Selectieve oplossing van elementair goud uit multimetaalbronnen in organische oplossingen
Selectieve oplossing van elementair goud uit multimetaalbronnen in organische oplossingen Onderzoekers ontwikkelen een algoritme om te bepalen hoe cellulaire ‘buurten’ in weefsels functioneren
Onderzoekers ontwikkelen een algoritme om te bepalen hoe cellulaire ‘buurten’ in weefsels functioneren  Waarom is chloride slecht voor je?
Waarom is chloride slecht voor je?  Contact opnemen met uw vertegenwoordiger over klimaatverandering
Contact opnemen met uw vertegenwoordiger over klimaatverandering  Elon Musk verwerpt astronomische zorgen over Starlink-netwerk
Elon Musk verwerpt astronomische zorgen over Starlink-netwerk Het begin van een revolutie in verpakkingen
Het begin van een revolutie in verpakkingen Vijf kenmerken van de Sun
Vijf kenmerken van de Sun
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


