
Wetenschap
Wat is de pH van een 0,067 M waterige oplossing natriumpropionaat NaC3H5O2?
1. Schrijf de uitgebalanceerde chemische vergelijking voor de dissociatie van natriumpropionaat in water:
NaC3H5O2(aq) → Na+(aq) + C3H5O2-(aq)
2. Het propionaation (C3H5O2-) is een zwakke base en zal hydrolyse in water ondergaan, waarbij hydroxide-ionen (OH-) worden geproduceerd en de pH van de oplossing stijgt. De reactie voor de hydrolyse van propionaation is:
C3H5O2-(aq) + H2O(l) ⇌ HC3H5O2(aq) + OH-(aq)
3. De evenwichtsconstante voor de hydrolyse van propionaation wordt gegeven door de base-dissociatieconstante (Kb) van propionzuur (HC3H5O2):
Kb =[HC3H5O2][OH-]/[C3H5O2-]
4. De waarde van Kb voor propionzuur is 1,34 × 10^-5 bij 25°C.
5. Ervan uitgaande dat de hydrolyse van propionaationen verwaarloosbaar is (wat een redelijke aanname is voor een oplossing van 0,067 M), kan de concentratie van door hydrolyse geproduceerde hydroxide-ionen worden berekend met behulp van de Kb-uitdrukking:
[OH-] =Kb[C3H5O2-]/[HC3H5O2] ≈ Kb[C3H5O2-]
6. Als we de waarde van Kb en de concentratie propionaationen vervangen door de bovenstaande vergelijking, krijgen we:
[OH-] ≈ (1,34 × 10^-5)(0,067) ≈ 9,0 × 10^-7 M
7. Ten slotte kunnen we de pH van de oplossing berekenen met behulp van de volgende vergelijking:
pH =-log[H3O+] =-log(Kw/[OH-])
waarbij Kw de ionenproductconstante voor water is (Kw =1,0 × 10^-14 bij 25°C).
8. Als we de waarde van [OH-] in de bovenstaande vergelijking invullen, krijgen we:
pH =-log(1,0 × 10^-14/9,0 × 10^-7) ≈ 8,75
Daarom is de pH van een 0,067 M waterige oplossing van natriumpropionaat ongeveer 8,75.
 Wanneer ze worden getroffen met een scherpe klap, hebben ionische verbindingen de neiging om wat te doen, terwijl metaalachtige stoffen van vorm veranderen?
Wanneer ze worden getroffen met een scherpe klap, hebben ionische verbindingen de neiging om wat te doen, terwijl metaalachtige stoffen van vorm veranderen?  Wie gaat er nu door met het valideren van forensische wetenschappelijke disciplines?
Wie gaat er nu door met het valideren van forensische wetenschappelijke disciplines? Nieuwe technologie verbetert de productie van waterstof
Nieuwe technologie verbetert de productie van waterstof Hoe een watermolecuul te splitsen
Hoe een watermolecuul te splitsen  IVF-boost:akoestische golven gebruiken om sperma van hoge kwaliteit te selecteren
IVF-boost:akoestische golven gebruiken om sperma van hoge kwaliteit te selecteren
Hoofdlijnen
- Samen gekweekte gewassen werken beter samen in slechts twee generaties
- Waar vindt ademhaling plaats?
- Het gebruik van van bacteriofaag afkomstige lysine om geurveroorzakende bacteriën in oksels aan te pakken
- Waarom hebben plantencellen zowel celwanden als celmembranen?
- Evolutie van een moordenaar:hoe Afrikaanse Salmonella de sprong maakte van de darm naar de bloedbaan
- Waarom de harde Sneeuwbalaarde onze vroegste meercellige voorouders op gang bracht
- Wat exporteert en importeert materialen in de cel?
- Hoe poliovirus cellen van binnenuit overneemt
- Door het bedrijf gesponsorde klinische CRISPR-onderzoeken starten in 2018
- Onderzoekers passen katalysatoren aan om productopbrengsten te verhogen, verlaag de scheidingskosten
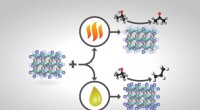
- Gegevensherinneringen van morgen:nieuwe technologie gebruiken om magneten met één molecuul in slow motion te verkennen

- Wetenschappers identificeren chemische oorzaken van vervaging van batterijcapaciteit
- Draait op leeg:nieuwe betaalbare katalysator is afhankelijk van stikstoftekorten om ammoniak te produceren

- Vliegen injecteren met slakkengif kan ons helpen moleculen te ontdekken voor het ontwikkelen van nieuwe medicijnen

 Hoe stof het aangezicht van de aarde veranderde
Hoe stof het aangezicht van de aarde veranderde  Het toevoegen van een polymeer stabiliseert instortende metaal-organische raamwerken
Het toevoegen van een polymeer stabiliseert instortende metaal-organische raamwerken Een nieuw type composietmateriaal met peapod-structuren kan de prestaties van lithium-ionbatterijen helpen verbeteren
Een nieuw type composietmateriaal met peapod-structuren kan de prestaties van lithium-ionbatterijen helpen verbeteren Nieuw kwantumonderzoek geeft inzichten in hoe licht onder de knie kan worden
Nieuw kwantumonderzoek geeft inzichten in hoe licht onder de knie kan worden  Geavanceerde statistische analyse benadrukt de rol van de interactie tussen rechters van het Amerikaanse Hooggerechtshof
Geavanceerde statistische analyse benadrukt de rol van de interactie tussen rechters van het Amerikaanse Hooggerechtshof  Hoe een machine te trainen om in het donker 3D te zien
Hoe een machine te trainen om in het donker 3D te zien Hoe hebben pesticiden de lucht beïnvloed?
Hoe hebben pesticiden de lucht beïnvloed?  Een nieuw materiaal voor de batterij van de toekomst
Een nieuw materiaal voor de batterij van de toekomst
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

