
Wetenschap
ALLEEN DE PROTONEN DIE AAN KOOLSTOF GEBONDEN ZIJN, in volgorde van zuurgraad aflopend, de volgende verbindingen CH3CH2OH, CH3COCH3, CH3COH, CH3COOCH3?
1. CH3COH> 2. CH3COOCH3> 3. CH3COCH3> 4. CH3CH2OH.
Dit komt omdat hoe elektronegatiever de substituenten zijn die aan de koolstof zijn gebonden, hoe meer ze de elektronendichtheid aan de koolstof-waterstofbinding zullen onttrekken, waardoor de waterstof zuurder wordt.
In CH3COH is het zuurstofatoom zeer elektronegatief en onttrekt het de elektronendichtheid aan de koolstof-waterstofbinding, waardoor de waterstof zuurder wordt. In CH3COOCH3 onttrekt het zuurstofatoom in de estergroep ook de elektronendichtheid aan de koolstof-waterstofbinding, maar in mindere mate dan in CH3COH. Dit komt omdat het zuurstofatoom in de estergroep ook gebonden is aan een koolstofatoom, dat de elektronendichtheid aan het zuurstofatoom schenkt. In CH3COCH3 is de methylgroep niet zo elektronegatief als het zuurstofatoom, en onttrekt dus niet zoveel elektronendichtheid aan de koolstof-waterstofbinding. Hierdoor is de waterstof in CH3COCH3 minder zuur dan de waterstof in CH3COH en CH3COOCH3. In CH3CH2OH is het waterstofatoom gebonden aan een koolstofatoom dat niet gebonden is aan elektronegatieve atomen. Dit maakt de waterstof in CH3CH2OH de minst zure van alle vier verbindingen.
 Wat is de vergelijking voor de reactie van zout carbonzuur met HCl?
Wat is de vergelijking voor de reactie van zout carbonzuur met HCl?  Nieuw membraanmateriaal kan zuivering van gassen aanzienlijk efficiënter maken
Nieuw membraanmateriaal kan zuivering van gassen aanzienlijk efficiënter maken Slim bulkplastic reageert op licht, temperatuur en vochtigheid
Slim bulkplastic reageert op licht, temperatuur en vochtigheid 10 soorten fysieke verandering
10 soorten fysieke verandering  Ontdekking van nieuwe eiwitvorm kan van invloed zijn op kanker- en neurodegeneratieve ziektetherapieën
Ontdekking van nieuwe eiwitvorm kan van invloed zijn op kanker- en neurodegeneratieve ziektetherapieën
 Wetenschappers onthullen hoe teerdeeltjes uit de rook van natuurbranden zonnestraling en licht in de atmosfeer absorberen en breken
Wetenschappers onthullen hoe teerdeeltjes uit de rook van natuurbranden zonnestraling en licht in de atmosfeer absorberen en breken  Bladeren vervuilen de grond met koolwaterstof
Bladeren vervuilen de grond met koolwaterstof Vorige maand was de warmste januari ooit, Amerikaanse wetenschappers zeggen:
Vorige maand was de warmste januari ooit, Amerikaanse wetenschappers zeggen: Mensen haten vluchtschaamte, maar niet genoeg om te stoppen met vliegen
Mensen haten vluchtschaamte, maar niet genoeg om te stoppen met vliegen Port Fourchon beschermen:wetenschappers leggen uit hoe sediment kan worden beheerd om landverlies te voorkomen en orkaanvoorbereiding te verbeteren
Port Fourchon beschermen:wetenschappers leggen uit hoe sediment kan worden beheerd om landverlies te voorkomen en orkaanvoorbereiding te verbeteren
Hoofdlijnen
- Onderzoeken hoe dierenzwermen reageren op bedreigingen
- Designerpeptiden tonen potentieel voor het blokkeren van virussen en moedigen toekomstig onderzoek aan
- Intracellulaire chemische signalen bekend als tweede boodschappers?
- Apenstudie toont een pad naar het monitoren van bedreigde diersoorten
- Welke klassen van biologische moleculen worden het gemakkelijkst geabsorbeerd en gemetaboliseerd door gist?
- Wat is antimaterie en waarom doet het ertoe?
- Natuurbeschermers moeten het Hollywood-effect benutten om dieren in het wild te helpen
- Eieren van wijnstokvretende insecten ontdekt op weg naar Californië:lopen wijngaarden gevaar?
- Wat doet een haai die gewoonlijk wordt geassocieerd met het noordpoolgebied in Belize?
- Onverwacht gedrag gezien bij efficiënte katalysatoren voor schone energie
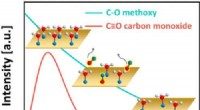
- Door zonlicht en afvalwaternitraat te combineren om 's werelds nummer 2 chemisch te maken

- Apparaat haalt water uit droge lucht, alleen aangedreven door de zon

- Onderzoekers ontdekken nieuwe manier om fotonen te splitsen en op te tellen met silicium

- Onderzoekers krijgen inzicht in hoe oplosmiddelmoleculen door licht gestuurde reacties beïnvloeden
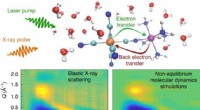
 Onderzoek toont de sociale voordelen van politieke incorrectheid aan
Onderzoek toont de sociale voordelen van politieke incorrectheid aan 2020 opnieuw een grimmig jaar voor het Braziliaanse Amazonegebied
2020 opnieuw een grimmig jaar voor het Braziliaanse Amazonegebied Voorbeelden van verdamping en destillatie
Voorbeelden van verdamping en destillatie  Is het element rhodium natuurlijk of door de mens gemaakt?
Is het element rhodium natuurlijk of door de mens gemaakt?  Nieuwe toolkit maakt simulaties van moleculaire dynamica toegankelijker
Nieuwe toolkit maakt simulaties van moleculaire dynamica toegankelijker  Radioactief afval:waar moet het naartoe?
Radioactief afval:waar moet het naartoe?  Hoe lichaamspantser werkt
Hoe lichaamspantser werkt  Roodlichtcamera's verminderen verkeersongevallen niet en verbeteren de openbare veiligheid niet:analyse
Roodlichtcamera's verminderen verkeersongevallen niet en verbeteren de openbare veiligheid niet:analyse
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

