
Wetenschap
Ontdekking van nieuwe eiwitvorm kan van invloed zijn op kanker- en neurodegeneratieve ziektetherapieën
Een onderzoeker van de Virginia Commonwealth University heeft een nieuwe conformatie van een gemeenschappelijke eiwitgroep ontdekt die verband houdt met kankermetastasen en neurodegeneratieve ziekten.
Qinglian Liu, doctoraat, een universitair hoofddocent bij de afdeling Fysiologie en Biofysica aan de VCU School of Medicine, vond onlangs een derde variatie in de structuur van het eiwittype Hsp70, die verantwoordelijk is voor de groei en het herstel van andere eiwitten. Haar bevindingen werden gepubliceerd in het tijdschrift Natuurcommunicatie op 31 oktober. De ontdekking zou uiteindelijk kunnen leiden tot de ontwikkeling van kleine moleculen die de functie van Hsp70 zouden kunnen verbeteren of verminderen.
Hsp70, of 70 kilodalton heat shock-eiwit, goed voor ongeveer 2 procent van de meer dan 100, 000 eiwitsoorten in het menselijk lichaam. Het eiwit is een chaperonne, wat betekent dat het andere eiwitten helpt een vorm te ontwikkelen. De vorm van een eiwit bepaalt mede de functie ervan. Wanneer eiwitten hun vorm verliezen door bederf door ziekten zoals koorts, of van omgevingsstressoren zoals overmatige blootstelling aan zonlicht, Hsp70 helpt hen te hervormen.
"Alles wat we doen, we kunnen doen omdat eiwitten functioneren, " zei Liu. "Onze cellen zijn gemaakt van eiwitten en ze moeten allemaal hun rol vervullen, vergelijkbaar met hoe iedereen een specifieke baan heeft in onze samenleving. Ze voegde eraan toe dat de rol van Hsp70 het behoud van de gezondheid van eiwitten is.
Het vinden van de derde vorm van Hsp70 helpt onderzoekers de biochemische functie van deze eiwitgroep te ontdekken.
"Begrijpen hoe de drie vormen in elkaar passen, onthult het proces dat Hsp70 doorloopt om eiwitten te vouwen, " zei Liu. "Als je alle vormen bij elkaar ziet, je kunt je een video voorstellen waarin ze achter elkaar werken om een eiwit te vouwen."
De eerste Hsp70-vorm werd ontdekt in 1996. Liu vond de tweede vorm in 2012 en meer vormen wachten op ontdekking na Liu's meest recente vondst.
Het vermogen van Hsp70 om eiwitten te vouwen en ze opnieuw op te bouwen zodra ze hun vorm verliezen, kan een deel van de sleutel zijn tot genezing van kanker en bepaalde neurologische ziekten, zei Liu.
Een overvloed aan Hsp70 is in verband gebracht met uitzaaiing van kanker. Hsp70 kan ervoor zorgen dat de eiwitten in kankercellen voortdurend vouwen, wat de celgroei verergert.
Het tegenovergestelde probleem doet zich voor bij patiënten met neurodegeneratieve ziekten zoals de ziekte van Alzheimer en Parkinson. In het geval van Alzheimer, patiënten ervaren gevaarlijke eiwitaggregaten in de hersenen, amyloïde plaques genaamd. In plaats van te worden gerepareerd nadat ze hun vorm hebben verloren, de eiwitten vormen deze schadelijke opbouw omdat er niet genoeg Hsp70's beschikbaar zijn om de eiwitten opnieuw te vouwen.
"We kunnen niet overleven zonder Hsp70, maar het moet in evenwicht zijn, " zei Liu. "We kunnen niet te veel of te weinig hebben. Zodra we meer weten over de activiteit van Hsp70, we kunnen kleine moleculen ontwerpen om de activiteit van het eiwit te moduleren, die de groei van bepaalde ziekten kunnen voorkomen of vertragen."
 grafeen, perovskieten, en silicium - een ideale tandem voor efficiënte zonnecellen
grafeen, perovskieten, en silicium - een ideale tandem voor efficiënte zonnecellen Scholen moleculaire vissen kunnen beeldschermen verbeteren
Scholen moleculaire vissen kunnen beeldschermen verbeteren Complexe moleculen maken in slechts een paar stappen
Complexe moleculen maken in slechts een paar stappen Elektronenoverdracht en oxidatieve schade in DNA in een biomimetische crowding-omgeving
Elektronenoverdracht en oxidatieve schade in DNA in een biomimetische crowding-omgeving Quick & Easy Science Fair Projects voor 8e Graders
Quick & Easy Science Fair Projects voor 8e Graders
 Betere neerslagvoorspellingen tot enkele uren van tevoren
Betere neerslagvoorspellingen tot enkele uren van tevoren Door droogte getroffen Kaapstad moet buitenaardse bomen kappen:studie
Door droogte getroffen Kaapstad moet buitenaardse bomen kappen:studie China lanceert satelliet voor monitoring van kooldioxide
China lanceert satelliet voor monitoring van kooldioxide Afschaffen van steenkool is de sleutel tot het terugdringen van de uitstoot van broeikasgassen, studie vondsten
Afschaffen van steenkool is de sleutel tot het terugdringen van de uitstoot van broeikasgassen, studie vondsten NASA's SnowEx daagt de detectietechnieken uit... totdat ze breken
NASA's SnowEx daagt de detectietechnieken uit... totdat ze breken
Hoofdlijnen
- Een 3D-model van een dier of plant maken Cell
- Overeenkomsten en verschillen tussen osmose en diffusie
- De juiste manier om DNA te repareren
- Elk levend wezen maakt deel uit van een ecosysteem. Hier is hoe ze werken
- Nieuw machine learning-systeem kan automatisch vormen van rode bloedcellen identificeren
- Oorlog tegen onkruid eist zijn tol van nuttige bacteriën in de bodem
- Het bacteriële sociale netwerk hacken
- Hoe een diercelmodel te maken
- Stappen van DNA Transcriptie
- Eenkristaltechnologie belooft veel voor lithium-ionbatterijen van de volgende generatie

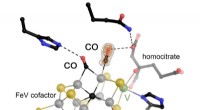
- Vanadiumafhankelijke stikstofase kan twee CO-moleculen tegelijk binden
- Belastingregel voor industrie beloont afvang van koolstof

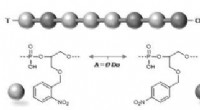
- Geheime berichten verborgen in lichtgevoelige polymeren
- Ultradunne zelfherstellende polymeren creëren nieuwe, duurzame waterafstotende coatings
 Noordwestelijke raket wordt op 22 juli gelanceerd om sterrenmateriaal te verkennen
Noordwestelijke raket wordt op 22 juli gelanceerd om sterrenmateriaal te verkennen Zelfherstellend beton kan de levensduur van constructies verlengen
Zelfherstellend beton kan de levensduur van constructies verlengen Algen en bacteriën werken samen om de waterstofproductie te verhogen
Algen en bacteriën werken samen om de waterstofproductie te verhogen Rangschikking van producten van opgevangen koolstofdioxide op klimaatvoordeel
Rangschikking van producten van opgevangen koolstofdioxide op klimaatvoordeel Onderzoekers printen materialen voor zachte robotica
Onderzoekers printen materialen voor zachte robotica Het Marangoni-effect kan worden gebruikt om zoet water uit de zee te halen
Het Marangoni-effect kan worden gebruikt om zoet water uit de zee te halen Nanorinkles kunnen miljarden besparen in scheepvaart en aquacultuur
Nanorinkles kunnen miljarden besparen in scheepvaart en aquacultuur Onderzoek naar gegevensverzameling door Google komt te midden van toegenomen toezicht op digitale privacy
Onderzoek naar gegevensverzameling door Google komt te midden van toegenomen toezicht op digitale privacy
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

