Wetenschap
Hoe het aantal neutronen in een Isotope
Atomen maken alles uit. Alles met massa en volume, groot of klein, bevat atomen. Verbazingwekkend genoeg bevatten de kleine atomen nog kleinere deeltjes. Protonen, neutronen en elektronen zijn de drie hoofdcomponenten van alle atomen. Het aantal en de rangschikking van deze drie onvoorstelbaar kleine deeltjes bepaalt de eigenschappen en het gedrag van de atomen die ze bevatten.
TL; DR (te lang; niet gelezen)
Om het aantal te vinden van neutronen in een isotoop, trek het aantal protonen af van de atoommassa van de isotoop. Het atoomnummer van het element is gelijk aan het aantal protonen. Berekening van het aantal neutronen wordt dan de atoommassa van de isotoop minus het atoomnummer van het element is gelijk aan het aantal neutronen. Voor uranium-235, atoomnummer 92, is het aantal neutronen 235-92 \u003d 143 of 143 neutronen.
Deeltjes in atomen
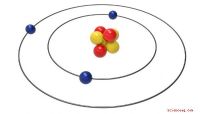
Bijna alle atomen bevatten drie hoofddeeltjes: protonen, neutronen en elektronen. Protonen en neutronen vormen de kern, of het centrum, van het atoom. Elektronen, veel kleiner dan de protonen en neutronen, omcirkelen de kern en rippen rond met de snelheid van het licht. Protonen hebben een positieve lading, neutronen hebben geen lading en elektronen hebben een negatieve lading. In een neutraal atoom is het aantal protonen gelijk aan het aantal elektronen, maar het aantal neutronen is niet altijd gelijk aan het aantal protonen.
Identificerende atomen
Het aantal protonen in een atoom bepaalt welke soort element dat het atoom vormt. Waterstof, het eerste element op het periodiek systeem, heeft slechts één proton. Helium, tweede op het periodiek systeem, heeft twee protonen. Goud, nummer 79 op het periodiek systeem, heeft 79 protonen. Het periodiek systeem der elementen toont de elementen in volgorde van het aantal protonen in de atomen.
Isotopen van atomen
Een isotoop van een element betekent atomen met hetzelfde atoomnummer maar met verschillende massagetallen. Dus, isotopen van een element hebben een ander aantal neutronen. Waterstof heeft drie isotopen. Waterstof, de meest voorkomende vorm van het atoom, heeft één proton en één elektron. Deuterium, één isotoop van waterstof, heeft nog steeds slechts één proton en één elektron, maar heeft ook één neutron. Tritium, een andere isotoop van waterstof, heeft nog steeds slechts één proton en één elektron maar heeft twee neutronen.
Neutronen berekenen
De massa van een atoom bestaat uit de gecombineerde massa's van de protonen en neutronen. De massa van de elektronen is te verwaarlozen in de totale massa van het atoom. Protonen meten ongeveer één atomaire massa-eenheid en neutronen meten slechts iets meer dan één atomaire massa-eenheid. Om het aantal neutronen in het atoom te bepalen, trekt u het atoomnummer af van de atoommassa.
Het atoomnummer en de gemiddelde atoommassa zijn te vinden in het periodiek systeem. De massa van verschillende isotopen wordt echter vaak geschreven als onderdeel van de naam van de isotoop. Uranium-235 betekent dat het element uranium, atoomnummer 92, 92 protonen heeft en een atoommassa van 235. Anderzijds heeft uranium-238 een massa van 238 maar heeft het nog slechts 92 protonen. Een alternatieve methode voor het schrijven van een isotoop toont de atoommassa als een superscript en het atoomnummer als een subscript. Uranium-235 kan ook worden geschreven als 235 92 U waarbij U de standaardafkorting is voor uranium. Met de waterstofisotopen als voorbeelden heeft het "normale" waterstofatoom een atoommassa van 1, en het atoomnummer is 1, wat betekent dat het atoom slechts één proton heeft. Met behulp van de formule geeft de atoommassa van 1 minus het atoomnummer, of het aantal protonen, van 1 de vergelijking 1-1 \u003d 0, dus het waterstofatoom heeft 0 neutronen. Aan de andere kant heeft tritium, een isotoop van waterstof, een atoommassa van 3, maar het atoomaantal waterstof blijft 1 omdat het atoom slechts één proton heeft. Met behulp van de vergelijking is atoommassa minus atoomnummer gelijk aan het aantal neutronen, geeft 3-1 \u003d 2, dus tritium heeft 2 neutronen. Een ander veel voorkomend element, koolstof, heeft ook verschillende isotopen. Het normale koolstofatoom, atoomnummer 6, heeft een atoommassa van 12. Met behulp van de formule is atoommassa min atoomnummer gelijk aan het aantal neutronen, toont dit 12-6 \u003d 6, dus het koolstof-12-atoom heeft 6 neutronen. Koolstof-14, gebruikt voor het radioactief dateren van fossielen jonger dan 10.000 jaar oud, heeft nog steeds 6 protonen maar heeft een atoommassa van 14. Het berekenen van het aantal neutronen gebruikt dezelfde formule, dus 14-6 \u003d 8, dus koolstof-14 heeft 8 neutronen in zijn kern.
Hoofdlijnen
- Vergelijking van klonen met mitose
- Plasmamembraan: definitie, structuur en functie (met diagram)
- De functies van de linker temporale kwab
- Zeldzame aardkers kan binnenkort overal zijn,
- Vier hoofdgroepen organische verbindingen waaruit levende organismen bestaan
- Hoe krijgen mensen stikstof in hun lichaam?
- Hoe maak je een modelhart met materialen uit je thuis
- Onderscheid Rigor Mortis van een Cadaveric Spasm
- Ervaren dieren geluk?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com