
Wetenschap
Onderzoekers ontwikkelen een nieuwe methode voor peptidesequencing op basis van nanoporie-detectietechnologie
Nieuwe technologie voor eiwitsequencing met verbeterde gevoeligheid en doorvoer zal een revolutie teweegbrengen op het gebied van proteomics en klinische diagnostiek.
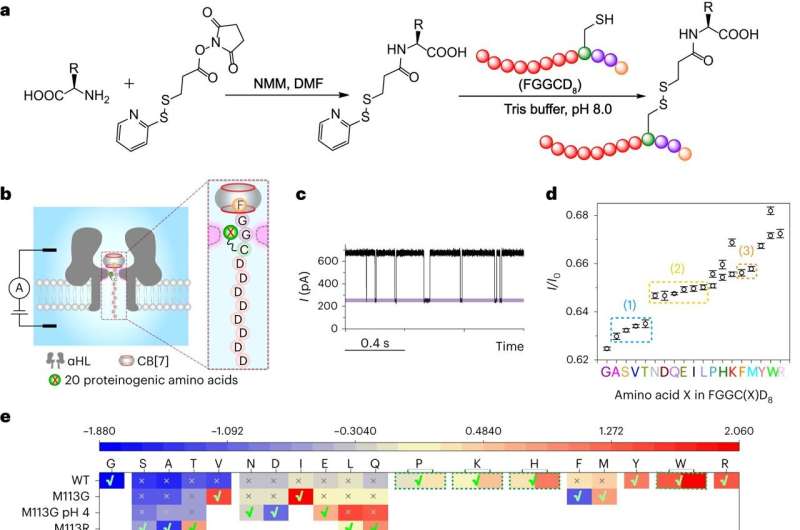
In een onderzoek gepubliceerd in Nature Methods heeft een onderzoeksteam onder leiding van prof. Wu Haichen van het Institute of Chemistry van de Chinese Academie van Wetenschappen (CAS), en prof. Liu Lei van het Institute of High Energy Physics van CAS, samen met hun medewerkers een nieuwe methode ontwikkeld voor peptidesequencing op basis van gastheer-gast-interactie-ondersteunde detectie van nanoporiën.
De geschiedenis van de eiwitsequencing zou terug kunnen gaan tot de bepaling van de volledige aminozuursequentie van insuline door Sanger in de jaren vijftig. Tot nu toe zijn er echter slechts twee belangrijke methoden voor eiwitsequencing, namelijk massaspectrometrie en Edman-degradatie.
Gedurende de afgelopen decennia is nanoporie-detectie naar voren gekomen als de nieuwste "ontwrichtende" techniek met één molecuul en heeft groot succes geboekt in de nieuwe generatie DNA-sequencing-ontwikkeling. Dit heeft wetenschappers geïnspireerd om de technologie te transplanteren naar eiwitsequencing met één molecuul. De nanoporiesequencing van eiwitten staat echter voor enorme uitdagingen, zoals de realisatie van een unidirectioneel transport van heterogeen geladen peptideketens door een nanoporie, en de elektrische identificatie van 20 individuele aminozuren of hun combinaties.
In deze studie stelden de onderzoekers een alternatieve sequencing-strategie voor, gebaseerd op een verbeterde gastheer-gast interactie-ondersteunde nanoporie-detectietechniek.
De modelpeptiden werden eerst gedigereerd met carboxypeptidasen om een mengsel van aminozuren op te leveren. De volgende belangrijke stap was het koppelen van de vrijgekomen aminozuren aan een FGGCD8⊂CB[7]-peptidesonde via een covalente linker en het vervolgens onderwerpen van het complex aan translocatie-experimenten via wildtype α-hemolysine of zijn mutanten.
Ten slotte werd de huidige blokkering van elk FGGC(X)D8⊂CB[7]-peptide gebruikt om het aminozuur X te identificeren en hun relatieve overvloed werd gebruikt om de volgorde van de enzymatische splitsing te bepalen, d.w.z. de sequentie van het peptide. /P>
Deze studie dient als proof-of-concept-demonstratie voor een nieuwe methode die in staat is om de aminozuursequentie van een peptide nauwkeurig te bepalen. Hoewel opmerkelijke beperkingen blijven bestaan, markeert dit een aanzienlijke vooruitgang en onthult het een veelbelovende weg voor de toekomst van eiwitsequencing.
Meer informatie: Yun Zhang et al, Peptidesequencing gebaseerd op gastheer-gast interactie-ondersteunde nanoporie-detectie, Natuurmethoden (2023). DOI:10.1038/s41592-023-02095-4
Journaalinformatie: Natuurmethoden
Aangeboden door de Chinese Academie van Wetenschappen
 Fluor stroomt naar binnen, maakt materiaal metaal
Fluor stroomt naar binnen, maakt materiaal metaal Organische elektronica:een nieuwe halfgeleider in de koolstofnitride-familie
Organische elektronica:een nieuwe halfgeleider in de koolstofnitride-familie Raman- en infraroodspectroscopie helpen bij het identificeren van verschillende geacetyleerde lysines
Raman- en infraroodspectroscopie helpen bij het identificeren van verschillende geacetyleerde lysines Focus op de zuurstofreductiereactie bij het zoeken naar efficiëntere waterstofcellen
Focus op de zuurstofreductiereactie bij het zoeken naar efficiëntere waterstofcellen Is Lemon Juice Clean Pennies beter dan azijn?
Is Lemon Juice Clean Pennies beter dan azijn?
 Ongekend vuur raast door munitielocatie in het bos van Berlijn
Ongekend vuur raast door munitielocatie in het bos van Berlijn Spinnen gevonden in New Mexico
Spinnen gevonden in New Mexico  Vloeipunten:een nieuwe methode voor het beheer van watervoorraden in bossen
Vloeipunten:een nieuwe methode voor het beheer van watervoorraden in bossen  Maria haalt uit naar Amerikaanse Maagdeneilanden terwijl Puerto Rico zich voorbereidt op impact
Maria haalt uit naar Amerikaanse Maagdeneilanden terwijl Puerto Rico zich voorbereidt op impact Regen getemd zomerseizoen van natuurbranden in Colorado, maar hoe lang houdt geluk stand?
Regen getemd zomerseizoen van natuurbranden in Colorado, maar hoe lang houdt geluk stand?
Hoofdlijnen
- Lijst van eencellige organismen
- Een biohybride robot gemaakt van meel en haver zou kunnen fungeren als een biologisch afbreekbare vector voor herbebossing
- Wat worden clusters van cellichamen genoemd?
- Beoordeling van Vaccinium-veredelingsonderzoek en vooruitzichten voor de toekomstige richtingen
- Hoe krijg je chloride-ionen in de cel
- Nieuw fundamenteel inzicht in de strijd tegen bacteriën
- Onderzoek van 300 miljoen jaar oude ontlasting vindt vlees op het menu
- Wat is het verschil tussen een protist en een menselijke huidcel?
- Hoe wolvenpersoonlijkheden wetlands kunnen veranderen
- AI zocht naar single-atom-alloy katalysatoren, 200 veelbelovende kandidaten gevonden
- Op de natuur geïnspireerde materialen kunnen worden gebruikt in toepassingen variërend van tunneling tot ruimtevaart

- 3D-printen van hiërarchische structuren van vloeibaar kristal-polymeer
- Slim papier kan elektriciteit geleiden, water detecteren

- Breedspectrum NLO-materialen verkregen door polykation-substitutie-geïnduceerde NLO-functionele motiefordening
 Sneeuwvalfrequentie neemt af in Noordwest, studie vondsten
Sneeuwvalfrequentie neemt af in Noordwest, studie vondsten Moet Amazon magazijnmedewerkers betalen terwijl ze wachten op beveiligingsonderzoeken? Pa. Hooggerechtshof zal beslissen
Moet Amazon magazijnmedewerkers betalen terwijl ze wachten op beveiligingsonderzoeken? Pa. Hooggerechtshof zal beslissen Restspanning ondanks mega aardbeving
Restspanning ondanks mega aardbeving Nederlands techbedrijf betrapt in rij VS-China
Nederlands techbedrijf betrapt in rij VS-China Onderzoekers detecteren een superstroom aan de rand van een supergeleider met een topologische twist
Onderzoekers detecteren een superstroom aan de rand van een supergeleider met een topologische twist Hoe kinderen die op school tegen gymles zijn, een sportieve kans kunnen krijgen
Hoe kinderen die op school tegen gymles zijn, een sportieve kans kunnen krijgen Data-analyse kan leiden tot nieuwe schaliegasrevolutie
Data-analyse kan leiden tot nieuwe schaliegasrevolutie Scienceweekprojecten van twee weken
Scienceweekprojecten van twee weken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

