
Wetenschap
De natuur leren om door de mens gemaakte chemische bindingen te verbreken
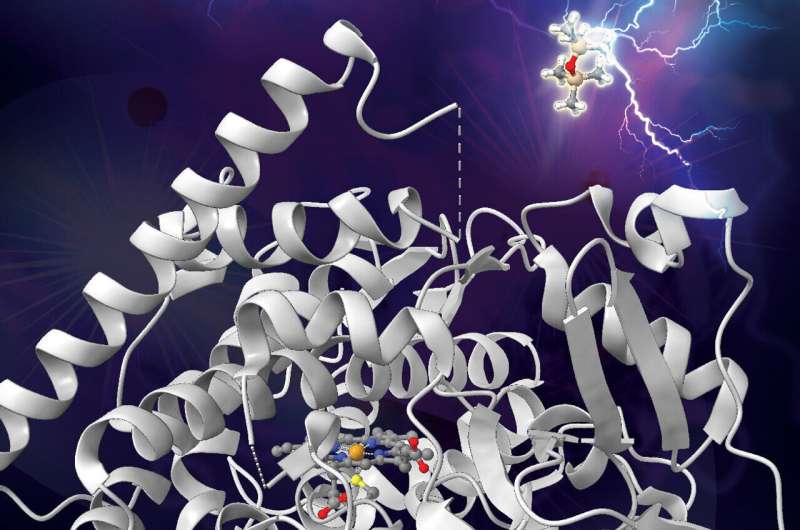
Voor het eerst hebben wetenschappers een enzym ontwikkeld dat de hardnekkige, door de mens gemaakte bindingen tussen silicium en koolstof, die voorkomen in veelgebruikte chemicaliën die bekend staan als siloxanen of siliconen, kan verbreken. De ontdekking is een eerste stap in de richting van het biologisch afbreekbaar maken van de chemicaliën, die in het milieu kunnen achterblijven.
"De natuur is een geweldige scheikundige, en haar repertoire omvat nu het verbreken van bindingen in siloxanen waarvan voorheen werd gedacht dat ze de aanval van levende organismen ontweken", zegt Frances Arnold, Linus Pauling hoogleraar chemische technologie, bio-engineering en biochemie bij Caltech en winnaar van de Nobelprijs van 2018. in de scheikunde voor haar baanbrekende werk op het gebied van gerichte evolutie, een methode voor het manipuleren van enzymen en andere eiwitten met behulp van de principes van kunstmatige selectie.
Arnold en haar collega's, waaronder Dimitris (Dimi) Katsoulis van het in Michigan gevestigde Dow Inc., gebruikten gerichte evolutie om het nieuwe silicium-koolstofbinding-splitsende enzym te creëren. De resultaten worden gepubliceerd in het tijdschrift Science .
De onderzoekers zeggen dat de praktische toepassingen van hun gemanipuleerde enzym misschien nog wel tien jaar of langer op zich laten wachten, maar dat de ontwikkeling ervan de mogelijkheid opent dat siloxanen op een dag biologisch kunnen worden afgebroken.
"Natuurlijke organismen zouden bijvoorbeeld kunnen evolueren in siloxaanrijke omgevingen om een soortgelijke reactie te katalyseren, of verder verbeterde versies van in het laboratorium ontwikkelde enzymen zoals deze zouden mogelijk kunnen worden gebruikt om siloxaanverontreinigingen in afvalwater te behandelen", zegt Arnold.
Katsoulis legt uit dat de natuur geen gebruik maakt van silicium-koolstofbindingen, “maar wij wel, en dat doen we al zo’n 80 jaar. De vluchtige aard van sommige van deze verbindingen rechtvaardigt gezondheids- en milieuonderzoek om de afbraakmechanismen van deze materialen in het milieu goed te begrijpen. ."
Siloxaanchemicaliën zijn te vinden in talloze producten, waaronder producten die worden gebruikt in huishoudelijke schoonmaakmiddelen, persoonlijke verzorging en de automobiel-, bouw-, elektronica- en ruimtevaartindustrie. De chemische ruggengraat van de verbindingen bestaat uit silicium-zuurstofbindingen, terwijl koolstofhoudende groepen, vaak methyl, aan de siliciumatomen zijn gehecht.
"De silicium-zuurstof-skelet geeft het polymeer een anorganisch karakter, terwijl de silicium-methylgroepen het polymeer organisch-achtige eigenschappen geven. Deze polymeren hebben dus unieke materiaaleigenschappen, zoals hoge thermische en oxidatieve stabiliteit, lage oppervlaktespanning en onder andere een hoge ruggengraatflexibiliteit", zegt Katsoulis.
Er wordt aangenomen dat siloxanen dagen tot maanden in het milieu blijven bestaan. Daarom is lopend onderzoek gericht op het verkrijgen van meer wetenschappelijk inzicht in de gezondheid en milieuveiligheid van siliconenmaterialen.
De chemicaliën beginnen op natuurlijke wijze in kleinere stukjes te fragmenteren, vooral in de bodem of in aquatische omgevingen, en die fragmenten worden vluchtig of ontsnappen in de lucht, waar ze worden afgebroken door te reageren met vrije radicalen in de atmosfeer. Van alle bindingen in siloxanen worden de silicium-koolstofbindingen het langzaamst afgebroken.
Katsoulis benaderde Arnold om samen te werken aan pogingen om de afbraak van siloxaan te versnellen nadat hij had gelezen over het werk van haar laboratorium om de natuur over te halen silicium-koolstofbindingen te produceren. In 2016 gebruikten Arnold en haar collega's gerichte evolutie om een bacterieel eiwit genaamd cytochroom c te manipuleren om silicium-koolstofbindingen te vormen, een proces dat in de natuur niet voorkomt.
"We besloten de natuur te laten doen wat alleen scheikundigen konden doen - alleen dan beter", zei Arnold. Het onderzoek toonde aan dat de biologie deze verbindingen kan maken op manieren die milieuvriendelijker zijn dan die traditioneel door scheikundigen worden gebruikt.
In de nieuwe studie wilden de onderzoekers manieren vinden om de banden te verbreken in plaats van ze te creëren. De wetenschappers gebruikten gerichte evolutie om een bacterieel enzym te ontwikkelen dat cytochroom P450 wordt genoemd.
Gerichte evolutie is vergelijkbaar met het fokken van honden of paarden, in die zin dat het proces is ontworpen om de gewenste eigenschappen naar voren te brengen. De onderzoekers identificeerden eerst een variant van cytochroom P450 in hun verzameling enzymen die een zeer zwak vermogen hadden om silicium-koolstofbindingen te verbreken in zogenaamde lineaire en cyclische vluchtige methylsiloxanen, een veel voorkomende subgroep van de siloxaanfamilie.
Ze muteerden het DNA van het cytochroom P450 en testten de nieuwe variant-enzymen. De best presterende producten werden vervolgens opnieuw gemuteerd en de tests werden herhaald totdat het enzym actief genoeg was om de onderzoekers in staat te stellen de producten van de reactie te identificeren en het mechanisme te bestuderen waarmee het enzym werkt.
"Evoluerende enzymen om deze bindingen in siloxanen te verbreken vormden unieke hindernissen. Met gerichte evolutie moeten we honderden nieuwe enzymen parallel evalueren om een paar enzymvarianten met verbeterde activiteit te identificeren", zegt Tyler Fulton (Ph.D.), co-leider auteur van de studie en postdoctoraal onderzoeker bij Caltech in het laboratorium van Arnold.
Eén uitdaging betrof de siloxaanmoleculen die plastic componenten lekten uit de platen met 96 putjes die werden gebruikt om de varianten te screenen. Om het probleem op te lossen heeft het team nieuwe platen gemaakt, gemaakt van gewone laboratoriumbenodigdheden.
"Een andere uitdaging was het vinden van het startenzym voor het gerichte evolutieproces, een enzym met zelfs maar een kleine hoeveelheid van de gewenste activiteit", zegt Arnold. "We vonden het in onze unieke verzameling cytochroom P450's die in het laboratorium zijn ontwikkeld voor andere vormen van nieuwe, nieuwe siliciumchemie."
Het uiteindelijke verbeterde enzym splitst de silicium-koolstofbinding niet direct, maar oxideert eerder een methylgroep in de siloxanen in twee opeenvolgende stappen. Kort gezegd betekent dit dat twee koolstof-waterstofbindingen worden vervangen door koolstof-zuurstofbindingen, en door deze verandering kan de silicium-koolstofbinding gemakkelijker worden verbroken.
Het onderzoek trekt parallellen met onderzoeken waarbij een plastic etend enzym betrokken is, legt Fulton uit, verwijzend naar een polyethyleentereftalaat (PET) afbrekend enzym dat in 2016 door een andere groep onderzoekers in de bacterie Ideonella sakaiensis werd ontdekt.
"Hoewel het PET-afbrekende enzym door de natuur werd ontdekt en niet door ingenieurs, inspireerde dat enzym andere innovaties die eindelijk hun vruchten afwerpen op het gebied van de afbraak van plastic. We hopen dat deze demonstratie op dezelfde manier zal inspireren tot verder werk om siloxaanverbindingen te helpen afbreken", zegt hij. .
Meer informatie: Nicholas S. Sarai et al, Gerichte evolutie van de enzymatische splitsing van silicium-koolstofbindingen in siloxanen, Wetenschap (2024). DOI:10.1126/science.adi5554. www.science.org/doi/10.1126/science.adi5554
Journaalinformatie: Wetenschap
Aangeboden door California Institute of Technology
 Driedimensionale Mn-gedoteerde nanosheets als efficiënte elektrokatalysatoren voor het splitsen van alkalisch water
Driedimensionale Mn-gedoteerde nanosheets als efficiënte elektrokatalysatoren voor het splitsen van alkalisch water Unieke methode om vrije-vormstructuren van thermoplasten te fabriceren in microdeeltjesgels
Unieke methode om vrije-vormstructuren van thermoplasten te fabriceren in microdeeltjesgels Hoe Bond Enthalpy te berekenen
Hoe Bond Enthalpy te berekenen  Groene aanpak versnelt procesoptimalisatie en terugwinning van schakelbare oplosmiddelen
Groene aanpak versnelt procesoptimalisatie en terugwinning van schakelbare oplosmiddelen Een stof in bruinkool kan virussen helpen bestrijden
Een stof in bruinkool kan virussen helpen bestrijden
 Verheffing van basalt van de Columbia-rivier opent een venster op hoe de regio werd gebeeldhouwd
Verheffing van basalt van de Columbia-rivier opent een venster op hoe de regio werd gebeeldhouwd Nieuwe studie beschrijft de resultaten van een langdurig partnerschap voor milieurechtvaardigheid in East End
Nieuwe studie beschrijft de resultaten van een langdurig partnerschap voor milieurechtvaardigheid in East End Frans Garfield-strandtelefoonmysterie benadrukt plasticvervuiling (update)
Frans Garfield-strandtelefoonmysterie benadrukt plasticvervuiling (update) Peru catastrofe gevreesd na 8, Amazone olieramp met 000 vaten
Peru catastrofe gevreesd na 8, Amazone olieramp met 000 vaten Nederland roept op om gasproductie Groningen met bijna de helft te verminderen
Nederland roept op om gasproductie Groningen met bijna de helft te verminderen
Hoofdlijnen
- De opkomst van vissen verlicht door ontdekking van fossielenschat
- Oesters sluiten hun schelpen als reactie op laagfrequente geluiden
- Hoe schakelen gewas-veeteeltsystemen over naar groene landbouwontwikkeling in het Baiyangdian Basin?
- Celcyclus Feiten
- Verontwaardiging na koala gevonden vastgeschroefd aan paal in Australië
- Tweekoppige slang een unieke vondst voor herpetologielab
- Biologen reizen met hun mobiele laboratorium om een breed scala aan mitochondriale functies bij vogelmigratie te bestuderen
- Drie decennia van onderzoek mondt uit in meer unieke orchideeënsoorten
- Welke dieren zijn het beste bestand tegen klimaatverandering?
- Onderzoekers maken doorbraak in antioxidant-enzym gekoppeld aan geelzucht
- Diagnostisch platform kan zich uitbreiden tot het detecteren van biomarkers voor ziekten

- Nieuwe AI-tool versnelt ontdekking van echt nieuwe materialen

- De zoektocht naar duurzame leeralternatieven

- Een fluorogene sonde kan de activiteit van multiresistente pathogenen in een testsysteem detecteren
 Opschalen van de productie van circuits van vloeibaar metaal
Opschalen van de productie van circuits van vloeibaar metaal Het Pentagon zegt dat er geen bewijs is van geheim Amerikaans werk op het gebied van buitenaardse technologie
Het Pentagon zegt dat er geen bewijs is van geheim Amerikaans werk op het gebied van buitenaardse technologie  Voor sommige inheemse stammen in de Zuidelijke Vlaktes is een origineel fluitlied de eerste stap op weg naar een huwelijk
Voor sommige inheemse stammen in de Zuidelijke Vlaktes is een origineel fluitlied de eerste stap op weg naar een huwelijk  De natuur beschermen de beste manier om de planeet koel te houden:rapport
De natuur beschermen de beste manier om de planeet koel te houden:rapport Drie overeenkomsten tussen een verbinding en een element
Drie overeenkomsten tussen een verbinding en een element Nanotechnologie versus virussen:onderzoekers introduceren innovatieve en kosteneffectieve antivirale middelen
Nanotechnologie versus virussen:onderzoekers introduceren innovatieve en kosteneffectieve antivirale middelen Studie van LGBTQ+-ervaring in de geowetenschappen levert moeilijkheden op, gevaren bij veldwerk
Studie van LGBTQ+-ervaring in de geowetenschappen levert moeilijkheden op, gevaren bij veldwerk Wetenschappers verouderen kwantumstippen in een reageerbuis
Wetenschappers verouderen kwantumstippen in een reageerbuis
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

