
Wetenschap
Eerste moleculaire inzichten in de afbraak van de ribosomale 30S-subeenheid
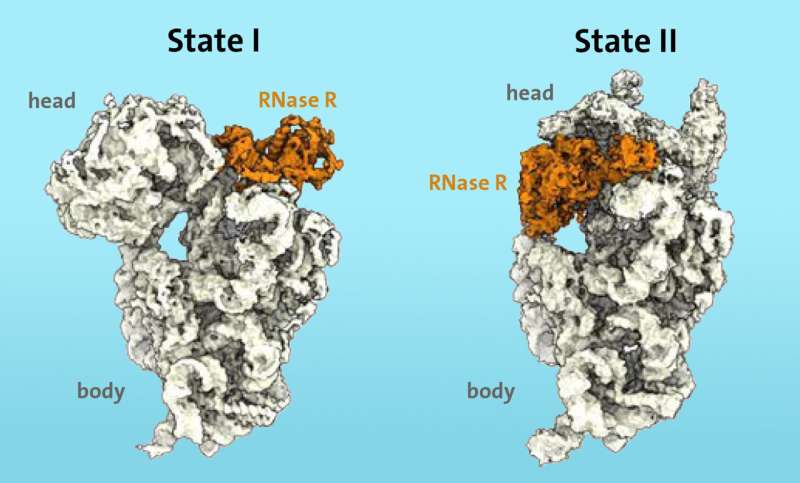
Een onderzoeksteam van de afdeling scheikunde van de Universität Hamburg is er voor het eerst in geslaagd om op moleculair niveau het dynamische mechanisme te identificeren dat door het enzym RNase R wordt gebruikt om de ribosomale 30S-subeenheid af te breken. De resultaten van het onderzoek zijn gepubliceerd in het wetenschappelijke tijdschrift Nature .
Eiwitsynthese is een vitaal en energie-intensief proces in de cel waarin ribosomen een cruciale rol spelen. Deze relatief grote moleculen worden in alle levende organismen aangetroffen en fungeren als de ‘eiwitfabrieken’ van de cel.
Om dit te doen, lezen ribosomen de blauwdruk voor een specifiek eiwit op een boodschappermolecuul – het boodschapper-RNA (mRNA) – en zetten deze informatie vervolgens om in een nieuw eiwit. Ribosomen bestaan uit twee subeenheden. De kleine subeenheid is verantwoordelijk voor het lezen en controleren van het mRNA op fouten, terwijl de grote subeenheid verantwoordelijk is voor de polymerisatie van aminozuren om eiwitten te vormen.
Voor de eiwitsynthese is een gecontroleerde productie en gereguleerde omzet van ribosomen vereist. Hoewel de assemblage van ribosomen de laatste jaren steeds beter wordt begrepen, bestaat er geen structureel inzicht in de afbraak van ribosomen.
Dit is belangrijk omdat cellen in stresssituaties zoals een gebrek aan voedsel of aan het einde van hun groeicyclus hun stofwisseling verminderen om langer te kunnen overleven. Deze toestand staat bekend als de stationaire fase. Tijdens deze fase wordt de energie-intensieve eiwitsynthese verminderd en worden sommige ribosomen afgebroken om de energie vrij te maken die erin is geïnvesteerd om de celoverleving te garanderen.
Voor hun onderzoek bestudeerden de onderzoekers Bacillus subtilis, een staafvormige bodembacterie die voorkomt in lucht, stof en water, maar ook in de darmen van mens en dier. “In tegenstelling tot eerdere studies hebben we cellen genomen die nog aan het groeien waren en niet in de stationaire fase. We wilden weten welke processen plaatsvinden bij de overgang naar de stationaire fase”, zegt dr. Helge Paternoga van de afdeling Scheikunde van het Universität Hamburg, laatste auteur van het onderzoek.
De onderzoekers wisten uit eerder werk dat bepaalde enzymen, zoals ribonuclease R (RNase R), betrokken zijn bij het afbraakproces van ribosomen in stresssituaties. Met behulp van cryo-elektronenmicroscopie konden ze voor het eerst aantonen dat het enzym RNase R bindt aan de kleine 30S-subeenheid van het ribosoom. De "S" staat voor "Svedberg-eenheden" en verwijst naar de massa van de ribosomale subeenheid.
De RNase R snijdt niet willekeurig de 30S-subeenheid door, maar hecht zich eerder aan een vrij gebied, dat de onderzoekers de 'nek' noemen, en maakt vervolgens het 'hoofd', het bovenste gebied van de subeenheid, los in twee opeenvolgende fasen. /P>
“In de eerste fase stuit het enzym RNase R op een obstakel bij de ‘nek’ en destabiliseert het nekgebied, waardoor het flexibeler wordt. In de tweede fase wordt het ‘hoofd’ gedraaid, waardoor het obstakel wordt weggenomen en het enzym de kans krijgt om zet het degradatieproces van de 30S-subeenheid ongehinderd voort", legt Paternoga uit.
"Onze in vitro afbraakexperimenten geven aan dat de 'head'-schakelaar een significante kinetische barrière is voor RNase R. Bovendien konden we aantonen dat het enzym alleen voldoende is om het volledige 30S-afbraakproces te volbrengen", zegt prof. dr. Daniel Wilson, hoofd van de onderzoeksgroep van de afdeling Scheikunde van de Universität Hamburg en co-auteur van het onderzoek.
Meer informatie: Lyudmila Dimitrova-Paternoga et al, Structurele basis van afbraak van ribosomale 30S-subeenheden door RNase R, Natuur (2024). DOI:10.1038/s41586-024-07027-6
Aangeboden door Universiteit van Hamburg
 Hier komt de zon
Hier komt de zon Gefunctionaliseerde oppervlakken:cilindrische micellaire borstels met op maat gemaakte chemische opties met gecontroleerde lengte
Gefunctionaliseerde oppervlakken:cilindrische micellaire borstels met op maat gemaakte chemische opties met gecontroleerde lengte De rol van hydrofobe moleculen in katalytische reacties
De rol van hydrofobe moleculen in katalytische reacties Wetenschappers ontwikkelen een nieuwe, zeer efficiënte fotokatalysator voor het verwijderen van kwik
Wetenschappers ontwikkelen een nieuwe, zeer efficiënte fotokatalysator voor het verwijderen van kwik  Waterstofauto's voor de massa een stap dichter bij de realiteit, dankzij UCLA-uitvinding
Waterstofauto's voor de massa een stap dichter bij de realiteit, dankzij UCLA-uitvinding
 Wetenschappers onderzoeken impact van zeer ernstige branden op naaldbossen
Wetenschappers onderzoeken impact van zeer ernstige branden op naaldbossen Wanneer de rivier hoog loopt
Wanneer de rivier hoog loopt Bladdaken:Puerto Rico wikkelt 2 jaar na orkaan Maria
Bladdaken:Puerto Rico wikkelt 2 jaar na orkaan Maria Vijf actieve vulkanen op mijn Asia Pacific Ring of Fire watch-lijst nu
Vijf actieve vulkanen op mijn Asia Pacific Ring of Fire watch-lijst nu Onderzoeker:Klimaatmodellen kunnen maandenlang op supercomputers draaien, maar mijn nieuwe algoritme kan ze tien keer sneller maken
Onderzoeker:Klimaatmodellen kunnen maandenlang op supercomputers draaien, maar mijn nieuwe algoritme kan ze tien keer sneller maken
Hoofdlijnen
- Als je Google het woord vinkje gebruikt, help je de wetenschap
- Zijn dubbelgangers echt? Er is een kans van 1 op een biljoen
- Wat doet Choline voor het lichaam?
- Middeleeuwse kist levert fascinerend skelet op
- Vier klassen van macromoleculen belangrijk voor levende dingen
- 5 manieren om optimistisch te blijven in een neergaande economie
- Genoomgrootte beïnvloedt of planten invasief worden
- Hoe hoogte te bepalen via het skelet
- De structuur en functie van spiercellen
- Nieuwe techniek zet ammoniak naadloos om in groene waterstof
- MXene-materialen helpen fotodetectoren het licht te zien

- Onderzoekers ontwerpen coatings om verstopping van pijpleidingen te voorkomen

- Microgolfplastic verlengt de levensduur van lithium-zwavelbatterijen

- Zeer efficiënte fotokatalysator die koolstofdioxide omzet in methaan
 Het synthetiseren van een nieuwe klasse van bio-geïnspireerde, lichtvangende nanomaterialen
Het synthetiseren van een nieuwe klasse van bio-geïnspireerde, lichtvangende nanomaterialen Onderzoekers meten de elektrische lading van nanodeeltjes
Onderzoekers meten de elektrische lading van nanodeeltjes Kunnen computers de lichtsnelheid bereiken?
Kunnen computers de lichtsnelheid bereiken? Het modelleren van de buurt verhoogt de voorspelling van aardverschuivingen
Het modelleren van de buurt verhoogt de voorspelling van aardverschuivingen Een metronoom voor kwantumdeeltjes
Een metronoom voor kwantumdeeltjes Wetenschappers bereiken real-time registratie van het ionisatieproces en de daaropvolgende structurele veranderingen
Wetenschappers bereiken real-time registratie van het ionisatieproces en de daaropvolgende structurele veranderingen  Weerstand van de consument tegen duurzaamheidsinterventies
Weerstand van de consument tegen duurzaamheidsinterventies Wat doen vlinders voor het milieu?
Wat doen vlinders voor het milieu?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

