
Wetenschap
Gebruik van elektrochemische technieken om katalysatoren voor duurzame brandstoffen te ontwerpen
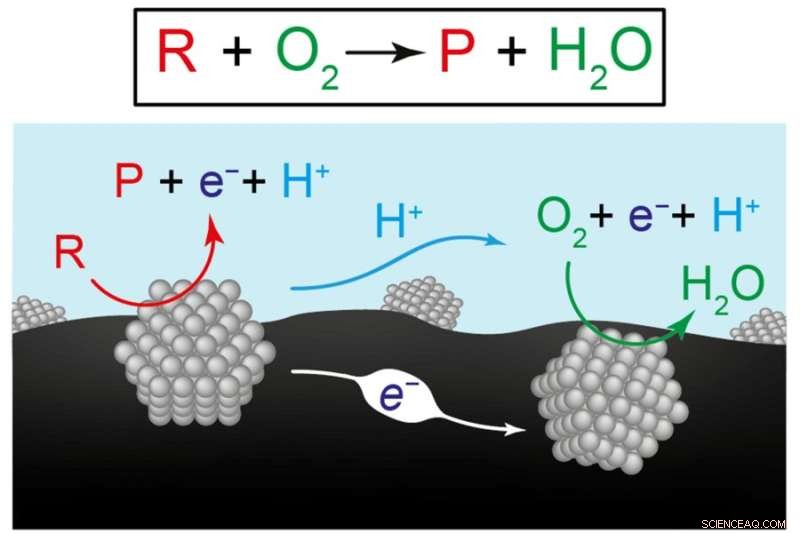
Deze figuur geeft twee weergaven van de chemische reacties voor de productie van hernieuwbare brandstoffen en chemicaliën. De bovenste vergelijking vertegenwoordigt de omzetting van de reactant (R) plus zuurstof (O2) naar een product (P) plus water (H2O). Het onderstaande diagram illustreert de hypothese van onderzoekers dat de algehele reactie het resultaat is van twee gecoördineerde halfreacties die plaatsvinden op afzonderlijke katalysatormaterialen, hier weergegeven door grijze structuren. Op de linkerkatalysator verandert de reactant in een product, waarbij elektronen (e-) in het koolstofdragermateriaal (zwart) en protonen (H+) in water (blauw) worden gestuurd. Op de rechterkatalysator worden elektronen en protonen verbruikt terwijl ze de reactie van zuurstof tot water aansturen. Credit:afbeelding met dank aan de onderzoekers.
Een uitdaging bij het koolstofarm maken van het energiesysteem is weten hoe om te gaan met nieuwe soorten brandstoffen. Traditionele brandstoffen zoals aardgas en olie kunnen worden gecombineerd met andere materialen en vervolgens worden verwarmd tot hoge temperaturen, zodat ze chemisch reageren om andere bruikbare brandstoffen of stoffen te produceren, of zelfs energie om werk te doen. Maar nieuwe materialen zoals biobrandstoffen kunnen niet zoveel warmte opnemen zonder kapot te gaan.
Een belangrijk ingrediënt in dergelijke chemische reacties is een speciaal ontworpen vaste katalysator die wordt toegevoegd om de reactie te laten plaatsvinden, maar die zelf niet wordt verbruikt in het proces. Bij traditionele materialen gaat de vaste katalysator typisch een interactie aan met een gas; maar bij brandstoffen die bijvoorbeeld zijn afgeleid van biomassa, moet de katalysator werken met een vloeistof - een speciale uitdaging voor degenen die katalysatoren ontwerpen.
Yogesh Surendranath, universitair hoofddocent scheikunde aan het MIT, richt zich al bijna tien jaar op chemische reacties tussen vaste katalysatoren en vloeistoffen, maar in een andere situatie:in plaats van warmte te gebruiken om reacties aan te drijven, voeren hij en zijn team elektriciteit in uit een batterij of een hernieuwbare bron zoals wind of zonne-energie om chemisch inactieve moleculen meer energie te geven zodat ze kunnen reageren. En de sleutel tot hun onderzoek is het ontwerpen en fabriceren van vaste katalysatoren die goed werken voor reacties met vloeistoffen.
Surendranath erkende de noodzaak om biomassa te gebruiken om duurzame vloeibare brandstoffen te ontwikkelen en vroeg zich af of hij en zijn team de principes die ze hebben geleerd over het ontwerpen van katalysatoren om vloeistof-vaste stof reacties met elektriciteit aan te drijven, konden toepassen op reacties die plaatsvinden op vloeistof-vaste grensvlakken zonder elke invoer van elektriciteit.
Tot hun verbazing ontdekten ze dat hun kennis direct relevant is. Waarom? "Wat we hebben ontdekt - verbazingwekkend - is dat zelfs als je geen draden op je katalysator aansluit, er kleine interne 'draden' zijn die de reactie doen", zegt Surendranath. "Dus, reacties waarvan mensen over het algemeen denken dat ze werken zonder enige stroom van stroom, houden in feite in dat elektronen van de ene plaats naar de andere pendelen." En dat betekent dat Surendranath en zijn team de krachtige technieken van de elektrochemie kunnen toepassen op het probleem van het ontwerpen van katalysatoren voor duurzame brandstoffen.
Een nieuwe hypothese
Hun werk was gericht op een klasse van chemische reacties die belangrijk zijn in de energietransitie, waarbij zuurstof wordt toegevoegd aan kleine organische (koolstofbevattende) moleculen zoals ethanol, methanol en mierenzuur. De conventionele veronderstelling is dat de reactant en zuurstof chemisch reageren om het product plus water te vormen. En een vaste katalysator - vaak een combinatie van metalen - is aanwezig om te voorzien in plaatsen waarop de reactant en zuurstof kunnen interageren.
Maar Surendranath stelde een andere kijk op wat er aan de hand is. In de gebruikelijke opstelling worden twee katalysatoren, elk bestaande uit vele nanodeeltjes, op een geleidend koolstofsubstraat gemonteerd en in water ondergedompeld. In die opstelling kunnen negatief geladen elektronen gemakkelijk door de koolstof stromen, terwijl positief geladen protonen gemakkelijk door water kunnen stromen.
Surendranath's hypothese was dat de omzetting van reactant naar product verloopt door middel van twee afzonderlijke "halfreacties" op de twee katalysatoren. Op één katalysator verandert de reactant in een product, waarbij elektronen in het koolstofsubstraat en protonen in het water worden gestuurd. Die elektronen en protonen worden opgepikt door de andere katalysator, waar ze de zuurstof-naar-wateromzetting aandrijven. Dus, in plaats van een enkele reactie, bereiken twee afzonderlijke maar gecoördineerde halfreacties samen de netto-omzetting van reactant in product.
Als gevolg hiervan omvat de algehele reactie eigenlijk geen netto-elektronenproductie of -consumptie. Het is een standaard "thermische" reactie die het gevolg is van de energie in de moleculen en misschien wat extra warmte. De conventionele benadering voor het ontwerpen van een katalysator voor een dergelijke reactie zou zich richten op het verhogen van de snelheid van die reactant-naar-productomzetting. En de beste katalysator voor dat soort reacties zou bijvoorbeeld goud of palladium of een ander duur edelmetaal kunnen zijn.
Als die reactie echter twee halfreacties omvat, zoals Surendranath voorstelde, is er een stroom van elektrische lading (de elektronen en protonen) daartussen. Dus Surendranath en anderen in het veld zouden in plaats daarvan elektrochemische technieken kunnen gebruiken om niet één enkele katalysator voor de algehele reactie te ontwerpen, maar eerder twee afzonderlijke katalysatoren - één om de ene halve reactie te versnellen en één om de andere halve reactie te versnellen. "Dat betekent dat we niet één katalysator hoeven te ontwerpen om al het zware werk te doen om de hele reactie te versnellen", zegt Surendranath. "We kunnen misschien twee goedkope, aardrijke katalysatoren combineren, die elk de helft van de reactie goed doen, en samen voeren ze de algehele transformatie snel en efficiënt uit."
Maar er is nog een overweging:elektronen kunnen door het hele katalysatorcomposiet stromen, dat het (de) katalysatordeeltje(s) en het koolstofsubstraat omvat. Om de chemische omzetting zo snel mogelijk te laten plaatsvinden, moet de snelheid waarmee elektronen in het katalysatorcomposiet worden geplaatst exact overeenkomen met de snelheid waarmee ze worden verwijderd. Als we ons concentreren op alleen de elektronen, als de omzetting van reactie naar product op de eerste katalysator hetzelfde aantal elektronen per seconde in het "elektronenbad" in het katalysatorcomposiet stuurt als de omzetting van zuurstof naar water op de tweede katalysator kost uit, zullen de twee halfreacties in evenwicht zijn en zal de elektronenstroom - en de snelheid van de gecombineerde reactie - snel zijn. De kunst is om voor elk van de halfreacties goede katalysatoren te vinden die perfect op elkaar zijn afgestemd wat betreft elektronen in en elektronen uit.
"Een goede katalysator of een paar katalysatoren kan een elektrisch potentiaal handhaven - in wezen een spanning - waarbij beide halfreacties snel en in evenwicht zijn", zegt Jaeyune Ryu Ph.D. '21, een voormalig lid van het Surendranath-lab en hoofdauteur van de studie; Ryu is nu een postdoc aan de Harvard University. "De snelheden van de reacties zijn gelijk en de spanning in het katalysatorcomposiet verandert niet tijdens de algehele thermische reactie."
Tekenen op elektrochemie
Op basis van hun nieuwe inzichten wendden Surendranath, Ryu en hun collega's zich tot elektrochemische technieken om een goede katalysator te identificeren voor elke halfreactie die ook zou samenwerken om goed samen te werken. Hun analytisch kader voor het begeleiden van de ontwikkeling van katalysatoren voor systemen die twee halfreacties combineren, is gebaseerd op een theorie die al bijna 100 jaar wordt gebruikt om corrosie te begrijpen, maar zelden is toegepast om katalysatoren te begrijpen of te ontwerpen voor reacties met kleine moleculen die belangrijk zijn voor de energy transition.
Key to their work is a potentiostat, a type of voltmeter that can either passively measure the voltage of a system or actively change the voltage to cause a reaction to occur. In their experiments, Surendranath and his team use the potentiostat to measure the voltage of the catalyst in real time, monitoring how it changes millisecond to millisecond. They then correlate those voltage measurements with simultaneous but separate measurements of the overall rate of catalysis to understand the reaction pathway.
For their study of the conversion of small, energy-related molecules, they first tested a series of catalysts to find good ones for each half-reaction—one to convert the reactant to product, producing electrons and protons, and another to convert the oxygen to water, consuming electrons and protons. In each case, a promising candidate would yield a rapid reaction—that is, a fast flow of electrons and protons out or in.
To help identify an effective catalyst for performing the first half-reaction, the researchers used their potentiostat to input carefully controlled voltages and measured the resulting current that flowed through the catalyst. A good catalyst will generate lots of current for little applied voltage; a poor catalyst will require high applied voltage to get the same amount of current. The team then followed the same procedure to identify a good catalyst for the second half-reaction.
To expedite the overall reaction, the researchers needed to find two catalysts that matched well—where the amount of current at a given applied voltage was high for each of them, ensuring that as one produced a rapid flow of electrons and protons, the other one consumed them at the same rate.
To test promising pairs, the researchers used the potentiostat to measure the voltage of the catalyst composite during net catalysis—not changing the voltage as before, but now just measuring it from tiny samples. In each test, the voltage will naturally settle at a certain level, and the goal is for that to happen when the rate of both reactions is high.
Validating their hypothesis and looking ahead
By testing the two half-reactions, the researchers could measure how the reaction rate for each one varied with changes in the applied voltage. From those measurements, they could predict the voltage at which the full reaction would proceed fastest. Measurements of the full reaction matched their predictions, supporting their hypothesis.
The team's novel approach of using electrochemistry techniques to examine reactions thought to be strictly thermal in nature provides new insights into the detailed steps by which those reactions occur and therefore into how to design catalysts to speed them up. "We can now use a divide-and-conquer strategy," says Ryu. "We know that the net thermal reaction in our study happens through two 'hidden' but coupled half-reactions, so we can aim to optimize one half-reaction at a time"—possibly using low-cost catalyst materials for one or both.
Adds Surendranath, "One of the things that we're excited about in this study is that the result is not final in and of itself. It has really seeded a brand-new thrust area in our research program, including new ways to design catalysts for the production and transformation of renewable fuels and chemicals." + Verder verkennen
Cheap, eco-friendly catalyst opens new possibilities for organic molecules built from pyruvate
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Niet-invasieve magnetische resonantiebeeldvorming van longfibrogenese met een op aminozuren gerichte sonde
Niet-invasieve magnetische resonantiebeeldvorming van longfibrogenese met een op aminozuren gerichte sonde Nieuwe supercondensors slaan elektrische lading op in textielmaterialen
Nieuwe supercondensors slaan elektrische lading op in textielmaterialen Een halfgeleiderchip detecteert antigeenconcentraties bij 1 delen per quadriljoen molmassa
Een halfgeleiderchip detecteert antigeenconcentraties bij 1 delen per quadriljoen molmassa Hydrofoob silica-colloïde-elektrolyt is veelbelovend voor veiligere lithium-zuurstofbatterijen
Hydrofoob silica-colloïde-elektrolyt is veelbelovend voor veiligere lithium-zuurstofbatterijen Zink Plating Process
Zink Plating Process
 Toerisme voornamelijk verantwoordelijk voor zwerfvuil op mediterrane stranden
Toerisme voornamelijk verantwoordelijk voor zwerfvuil op mediterrane stranden Californië geeft EPA de schuld van vastgelopen plannen om vervuiling te beteugelen
Californië geeft EPA de schuld van vastgelopen plannen om vervuiling te beteugelen Beschermt tegen de opwarming van de aarde
Beschermt tegen de opwarming van de aarde Een vuurspuwende draak helpt bij het bestrijden van aanvallen van sintels op gebouwen met rieten daken
Een vuurspuwende draak helpt bij het bestrijden van aanvallen van sintels op gebouwen met rieten daken De uitstoot van kooldioxide in de VS is tijdens de pandemie tot een ongekend laag niveau gedaald
De uitstoot van kooldioxide in de VS is tijdens de pandemie tot een ongekend laag niveau gedaald
Hoofdlijnen
- Wat zijn de verschillen tussen een oog van een koe en een menselijk oog?
- Huilende olifanten en giechelende ratten - dieren hebben gevoelens, te
- Kenia mannelijke leeuwen gezien in intieme daad; binding, deskundigen zeggen
- Bestrijding van het witte-neussyndroom bij vleermuizen
- Bloemstroken en heggen geven samen een boost aan bijen in boomgaarden
- Waar bestaat het cytoplasma uit?
- Continentale controles nodig om de strijd tegen boomziekten te handhaven
- Verschillen tussen codering en sjabloondraden
- Extreme zoutstress veroorzaakt bladbeweging
- In gloeiende kleuren:de verspreiding van medicijndeeltjes in een forensisch laboratorium zien

- Microgestructureerd materiaal met ruimtelijke variatie heeft wrijving in slechts één richting

- Zeer uniforme en lage hysterese druksensor om de praktische toepasbaarheid te vergroten

- Principes voor een groene chemietoekomst

- Met trucs voor materiaalverwerking kunnen ingenieurs nieuw lasermateriaal maken

 Waarom blijven we onze monsters schattig maken?
Waarom blijven we onze monsters schattig maken?  Krijg je geld terug als COVID-19 je campus sluit?
Krijg je geld terug als COVID-19 je campus sluit? Wat is een graslandbiomeen?
Wat is een graslandbiomeen?  Een revolutionaire atoomdunne halfgeleider voor elektronica
Een revolutionaire atoomdunne halfgeleider voor elektronica FDA-doorbraakstatus voor screeningalgoritme stimuleert hoop om risico's op hartfalen te signaleren
FDA-doorbraakstatus voor screeningalgoritme stimuleert hoop om risico's op hartfalen te signaleren Frankrijk klimt aan boord van waterstoftreinrevolutie
Frankrijk klimt aan boord van waterstoftreinrevolutie Duinen gebruiken om wind op Mars te interpreteren
Duinen gebruiken om wind op Mars te interpreteren Nieuwe studie belicht eerste infectie van menselijke cellen tijdens ruimtevlucht
Nieuwe studie belicht eerste infectie van menselijke cellen tijdens ruimtevlucht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

